
Volumen 21 - Número 5 - Diciembre 2013
Biopsias intraoculares
M. Asencio-Duran1, B.Vicandi-Plaza2, J.M. Viguer García-Moreno2
1Departamento de Oftalmología. Hospital Universitario La Paz. Madrid.
2Citopatología Clínica. Departamento de Anatomía Patológica. Hospital Universitario La Paz. Madrid.
2Citopatología Clínica. Departamento de Anatomía Patológica. Hospital Universitario La Paz. Madrid.
CORRESPONDENCIA
Mónica Asencio Duran
E-mail: masedur@hotmail.com
E-mail: masedur@hotmail.com
Introducción
Los tumores intraoculares generalmente no presentan problemas diagnósticos, ya que en la mayoría de los casos la evaluación mediante funduscopia y ecografía nos proporciona hallazgos suficientes para llegar a un diagnóstico correcto.Indicaciones, contraindicaciones y limitaciones
En general, la principal indicación de la biopsia intraocular es cuando la clínica y las pruebas diagnósticas no proporcionan el diagnóstico, lo cual ocurre sólo en el 2,5% de los casos1, como aquellos con presentación atípica, opacidad de medios, sospecha de metástasis sin tumor primario conocido y por petición expresa de diagnóstico citogenético por parte del paciente.Se debe contraindicar en masas coroideas con diagnóstico bien establecido, en el diagnóstico diferencial de lesiones melanocíticas pequeñas y en lesiones en que se planea su resección.
A pesar de ser una técnica bastante específica, presenta una serie de limitaciones:
- Que la muestra sea insuficiente debido a la limitada celularidad obtenida, o falsamente negativa por la heterogeneidad celular del tumor, lo cual no debe considerarse inequívocamente como prueba de ausencia de malignidad.
- Que sea falsa positiva, lo cual puede suceder en el melanocitoma y el nevus epitelioide2, debido a la presencia de células epitelioides, tradicionalmente consideradas malignas, en algunos de estos casos.
Técnicas e instrumentaciones
Existen básicamente tres técnicas de diagnóstico citológico en los tumores intraoculares: la aspiración de fluidos oculares (acuoso, vítreo), la vitrectomía diagnóstica y la punción-aspiración con aguja fina (PAAF). La técnica empleada dependerá del tejido afectado, del diagnóstico de sospecha, del tamaño y la localización de la masa, y de la presencia de desprendimiento de retina asociado o de opacidad de medios.Tumores de iris
En general se emplea una aguja de 26 a 30 G, a través de la cámara anterior, y con un ángulo de 45-90° sobre la superficie del tumor se aspiran unos 0,5 ml de acuoso3, aunque otros autores abogan por la inserción directa sobre el tumor4. En el linfoma intraocular con células visibles en CA es más habitual la realización de paracentesis (Figura 1), mientras que en otros casos es posible el abordaje a través de una vitrectomía.

Figura 1. 1A. Paciente remitida con diagnóstico de uveitis anterior aguda (UAA) hipertensiva con hipopion. Lavado de cámara anterior negativo. 1B. En la citología se aprecia una gran celularidad monomorfa, con núcleo redondo y nucléolo patente. 1C. La tinción inmunocitoquímica confirma la positividad de todas las células frente al antígeno común leucocitario CD45 y para la estirpe linfoide B CD20.
Tumores de segmento posterior
- Abordaje transescleral: indicado en tumores del cuerpo ciliar o de coroides anterior. Se utiliza una aguja de calibre fino (25-27G) conectada a una alargadera. Se realiza un colgajo escleral de 3 mm2, de un 80% de profundidad, y una pequeña incisión en su lecho5. Es preferible presuturar antes de realizar la PAAF a través de la microincisión, para poder cerrar inmediatamente después y así evitar la diseminación, y es recomendable hacerlo antes del implante de la placa radiactiva.
- Abordaje transvítreo: indicado en tumores posteriores. Se utiliza una aguja 25 a 30 G larga conectada a una alargadera (Figura 2). Se incide desde el lado contrario, a 180°, a 4 mm del limbo, mediante control bajo oftalmoscopio indirecto o microscopio6. En los tumores planos puede doblarse la aguja 90° para permitir una entrada tangencial en el tumor. Una vez que la aguja se ha insertado en el tumor, puede rotarse alrededor de su eje para obtener más material, y una vez aspirada la cantidad necesaria no hay que soltar el émbolo de la jeringa hasta que la aguja salga del ojo, para evitar la diseminación. Si se produce hipotonía ocular, puede inyectarse solución salina balanceada.
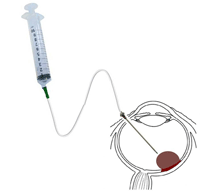
Figura 2. Técnica de PAAF para citología de tumores de segmento posterior.El trayecto de la aguja puede visualizarse a través de la pupila dilatadapor oftalmoscopia indirecta o mediante microscopio quirúrgico y sistema de inversión de imagen. La aspiración puede hacerse manualmente con jeringa, como se aprecia en la imagen, o mediante un sistema de aspiración automatizada como la del vitrectomo.
- Vitrectomía: también indicada en tumores posteriores y específicamente en el linfoma vitreo tretiniano primario (LVRP)7. Permite obtener muestras más celulares que las tomadas con PAAF, pero tiene más complicaciones. Es especialmente útil si es necesaria la extirpación del vítreo. Para acceder al tejido subretinia no debe realizarse una retinotomía pequeña, que en general no requiere taponamiento con gas ni tratamiento con fotocoagulación8.
Complicaciones
La principal causa de la escasa utilización de la biopsia intraocular es su carácter invasivo y el riesgo de diseminación tumoral que conlleva9, que se reduce cuando se realiza en manos expertas y con aguja de calibre. Otras complicaciones locales son la hemorragia en el sitio de punción (Figura 3) que típicamente se soluciona en pocos días, la hemorragia vítrea y subretiniana que ocurre en el 9% al 13% de los casos con disminución transitoria de visión, y otras teóricas como el desprendimiento de retina, la endoftalmitis y la diseminación sistémica, que no se han descrito.

Figura 3.3A. Hemorragia local tras PAAF transvítrea en un paciente con sospecha de metástasis sin tumor primario conocido. Se aprecia el corte con la tomografía de coherencia óptica (UCT), en la que se aprecia la retinotomía resultante de pequeño tamaño. 3B. Estudio citológico compatible con el diagnóstico de adenocarcinoma pulmonar secretor oculto.
Preparación citológica de las muestras
En el momento de extracción de la aguja del tumor hay que tener en cuenta las siguientes precauciones: mantener la presión negativa en la jeringa (evita el reflujo y la consecuente pérdida de células o diseminación), lavar profusamente la jeringa para extraer todo el material posible, y enviar rápido la muestra al laboratorio (en especial en el caso del linfoma, cuyas células sobreviven poco tiempo). El material que se remite a citología puede iren fresco (en portas, mediante extensión directa, secados al aire) o fijado (en suspensión en fluido de citología líquida, como Cytolyt® u otro medio de transporte) (Figura 4).
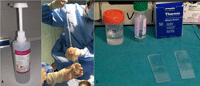
Figura 4.4A. Lavado profuso de la jeringa. 4B. Líquido fijador Cytolyt®. 4C. Portas con muestra en fresco y frascos con muestra fijada en Cytolyt®.
Para el procesado, los portas secados al aire se tiñen con técnica de Diff-Quick, mientras que la suspensión en líquido fijador se somete a técnicas de concentración celular (Citospin) y tinción de Papanicolaou, y si fuera necesario se realiza inmunohistoquímica. Es fundamental la interpretación por un citopatólogo experimentado, debido al escaso rendimiento celular que en ocasiones se obtiene.
Diagnóstico citogenético en tumores intraoculares
La citología en el melanoma uveal muestra los característicos gránulos de melanina y nos permite su clasificación en tres variantes: fusiforme, mixto y epitelioide (Clasificación modificada de Callender) según el porcentaje de células epitelioides existentes, lo que nos ayuda a establecer el pronóstico de estos pacientes10. Mayor rentabilidad pronóstica en esta patología se obtiene mediante el estudio de estas células con un simple cariotipado (la monosomía del cromosoma 3 aparece en el 56%, y diferentes estudios demuestran que el 50% desarrollan metástasis a 3 años11), o con otras técnicas moleculares más sofisticadas, como la fluorescencia por hibridación in situ (FISH), el polimorfismo de nucleótido único (SNP array) o más recientemente el perfil de expresión génica (Gene expression profiling), técnica que mide la expresión en ARN mensajero de múltiples genes y nos permite clasificar el melanoma uveal en dos subtipos: clase 1 (con bajo riesgo de metástasis) y clase 2 (con alto riesgo)12.Las técnicas inmunohistoquímicas generalmente sólo se utilizan en el diagnóstico diferencial de lesiones amelanóticas, sobre todo cuando se sospecha una metástasis coroidea, y en estos casos la biopsia tiene una correlación del 95% con la histología13 (Tabla 1 y Tabla 2). Ante una posible metástasis coroidea, la morfología celular, la cohesión celular y la ausencia de melanina suelen ser suficientes, pero en casos de ausencia de tumor primario conocido se debe priorizar la inmunohistoquímica.

Tabla 1. Marcadores inmunohistoquímicos más utilizados en los tumores melanocíticos13.

Tabla 2. Marcadores inmunohistoquímicos más utilizados en los tumores amelanóticos15.
Para el diagnóstico del LVRP, generalmente linfomas B de bajo grado, la colaboración con el citopatólogo debe ser muy estrecha, ya que el pronóstico vital de estos pacientes puede estar condicionado por la premura y la eficacia diagnóstica de la citología ocular, y quizás sea necesario realizar pruebas de laboratorio más específicas, como la citometría de flujo14.
Bibliografía
- Bechrakis NE, Foerster MH, Bornfeld N. Biopsy in indeterminate intraocular tumors. Ophthalmology. 2002;109:235-42.
- Ylagan LR. Intraocular pigmented proliferations in the context of cytologic evaluation. Diagn Cytopathol. 2009;37:853-64.
- Grossniklaus HE. Fine-needle aspiration biopsy of the iris. Arch Ophthalmol. 1992;110:969-76.
- Shields CL, Manquez ME, Ehya H, et al. Fine-needle aspiration biopsy of iris tumors in 100 consecutive cases: technique and complications. Ophthalmology. 2006;113:2080-6.
- Gündüz K, Shields JA, Shields CL, et al. Transscleral choroidal biopsy in the diagnosis of choroidal lymphoma. Surv Ophthalmol. 1999;43(6):551-5.
- Augsburger JJ, Shields JA. Fine needle aspiration biopsy of solid intraocular tumors: indications, instrumentation and techniques. Ophthalmic Surg. 1984;15:34-40.
- Char DH, Ljung BM, Deschenes J, et al. Intraocular lymphoma: immunological and cytological diagnosis. Br J Ophthalmol. 1988;72:905-11.
- Sen J, Groenewald C, Hiscott PS, et al. Transretinalchoroidal tumor biopsy with a 25-gauge vitrector. Ophthalmology. 2006;113:1028–31.
- Caminal JM, Sanz S, Carreras M, et al. Epibulbar seeding at the site of a transvitreal fine-needle aspiration biopsy. Arch Ophthalmol. 2006;124(4):587-9.
- Seddon JM, Albert DM, Lavin PT, et al. A prognostic factor study of disease-free interval and survival following enucleation for uveal melanoma. Arch Ophthalmol. 1983;101(12):1894-9.
- Prescher G, Bornfeld N, Hirche H. Prognostic implications of monosomy 3 in uveal melanoma. Lancet. 1996; 347;1222-5.
- Onken MD, Worley LA, Harbour JW. Association between gene expression profile, proliferation and metastasis in uveal melanoma. Curr Eye Res. 2010;35(9):857-63.
- Shields JA, Shields CL, Ehya H, et al. Fine-needle aspiration biopsy of suspected intraocular tumors: the 1992 Urwick lecture. Ophthalmology. 1993;100:1677-84.
- Asencio-Duran M, Vallejo-García JL, Pastora-Salvador N, et al. Vitreous diagnosis in neoplastic diseases. Mediators Inflamm. 2012;2012:930704. Review.
- Matilla Rodero M. Caracterización patobiológica del melanoma uveal. Tesis doctoral. Málaga: Universidad de Málaga; 2003.

