
Volumen 23 - Número 5 - Diciembre 2015
Anillo de Krumeich en queratoplastias penetrantes de alto riesgo
R. Quilendrino1, L. Pinilla1, M. Fideliz de la Paz1,2, S. Planella1,2, J. Álvarez de Toledo1,2
1Institut Universitàri Barraquer. Barcelona. 2Centro de Oftalmología Barraquer. Barcelona.
CORRESPONDENCIA
Maria Fideliz de la Paz
E-mail: lizeldelapaz@yahoo.com
E-mail: lizeldelapaz@yahoo.com
RESUMEN
Objetivo: Estudiar los resultados clínicos que se producen en pacientes operados de queratoplastia penetrante con implante de anillo intraestromal de Krumeich en corneas de alto riesgo.
Metodología: Para ello se realizó un estudio retrospectivo de una serie de 27 ojos de 26 pacientes, considerados receptores de alto riesgo, que se sometieron a una queratoplastia penetrante con implante de anillo intraestromal de Krumeich.
Las principales variables fueron la agudeza visual mejor corregida (MAVC), el cilindro topográfico, la transparencia corneal, la neovascularización corneal, la aparición de reacciones inmunológicas y otras complicaciones.
Resultados: La media de seguimiento fue de 16 meses. La agudeza visual postoperatoria con y sin corrección fue significativamente mejor que los valores registrados en el preoperatorio.
No se observaron diferencias estadísticamente significativas en cuánto al astigmatismo durante el periodo de seguimiento. La transparencia del injerto permaneció estable en 17 ojos (63%). En la mayoría de los casos (89%) se observó una menor densidad de vascularización corneal y la modificación de su trayecto debido a la presencia del anillo de Krumeich. En cuanto a reacciones inmunológicas, éstas fueron descritas en 6 ojos (22%) y sólo un ojo progresó hacia el fallo del injerto. Otras complicaciones postoperatorias incluidas fueron, 2 descompensaciones del injerto, 2 infecciones, 1 recurrencia por virus herpes simple y una extrusión del anillo.
Conclusión: La colocación del anillo intraestromal metálico de Krumeich es una opción segura y eficaz en queratoplastias penetrantes de alto riesgo potenciando la supervivencia del injerto, así como reduciendo la aparición de reacciones inmunológicas e inhibiendo la neovascularización corneal.
Metodología: Para ello se realizó un estudio retrospectivo de una serie de 27 ojos de 26 pacientes, considerados receptores de alto riesgo, que se sometieron a una queratoplastia penetrante con implante de anillo intraestromal de Krumeich.
Las principales variables fueron la agudeza visual mejor corregida (MAVC), el cilindro topográfico, la transparencia corneal, la neovascularización corneal, la aparición de reacciones inmunológicas y otras complicaciones.
Resultados: La media de seguimiento fue de 16 meses. La agudeza visual postoperatoria con y sin corrección fue significativamente mejor que los valores registrados en el preoperatorio.
No se observaron diferencias estadísticamente significativas en cuánto al astigmatismo durante el periodo de seguimiento. La transparencia del injerto permaneció estable en 17 ojos (63%). En la mayoría de los casos (89%) se observó una menor densidad de vascularización corneal y la modificación de su trayecto debido a la presencia del anillo de Krumeich. En cuanto a reacciones inmunológicas, éstas fueron descritas en 6 ojos (22%) y sólo un ojo progresó hacia el fallo del injerto. Otras complicaciones postoperatorias incluidas fueron, 2 descompensaciones del injerto, 2 infecciones, 1 recurrencia por virus herpes simple y una extrusión del anillo.
Conclusión: La colocación del anillo intraestromal metálico de Krumeich es una opción segura y eficaz en queratoplastias penetrantes de alto riesgo potenciando la supervivencia del injerto, así como reduciendo la aparición de reacciones inmunológicas e inhibiendo la neovascularización corneal.
RESUM
Objectiu: Estudiar els resultats clínics que es produeixen en pacients amb còrnies d’alt risc, operats de queratoplàstia penetrant amb implant d’anell intraestromal de Krumeich.
Metodologia: Es realitza un estudi retrospectiu d’una sèrie de 27 ulls de 26 pacients considerats receptors d’alt risc, que són intervinguts de queratoplàstia penetrant amb implant d’anell intraestromal de Krumeich. Les variables principals de l’estudi són: l’agudesa visual millor corregida (AVCC), el cilindre topogràfic, la transparència corneal, la neovascularització corneal i l’aparició de reaccions immunològiques i altres complicacions.
Resultats: La mitja de seguiment va ser de 16 mesos. L’agudesa visual postoperatòria amb i sense correcció va ser significativament millor que els valors registrats en el preoperatòri.
No s’observen diferències estadísticament significatives respecte l’astigmatisme durant el seguiment. La transparència de l’empelt va romandre estable en 17 ulls (63%). En la majoria dels casos (89%) es va observar una reducció de la densitat de la vascularització corneal i la modificació del seu trajecte degut a la presencia de l’anell de Krumeich. En quant a les reaccions immunològiques, van ser descrites en 6 ulls (22%) i només un ull va derivar en una fallada de l’empelt. Les altres complicacions postoperatòries que van tenir lloc van ser 2 descompensacions de l’empelt, 2 infeccions, 1 recurrència per virus herpes simple i una extrusió de l’anell.
Conclusió: La col•locació de l’anell intraestromal metàl•lic de Krumeich és una opció segura i eficaç en queratoplàsties penetrants d’alt risc potenciant la supervivència de l’empelt, així com disminuint l’aparició de reaccions immunològiques i inhibint la neovascularització corneal.
Metodologia: Es realitza un estudi retrospectiu d’una sèrie de 27 ulls de 26 pacients considerats receptors d’alt risc, que són intervinguts de queratoplàstia penetrant amb implant d’anell intraestromal de Krumeich. Les variables principals de l’estudi són: l’agudesa visual millor corregida (AVCC), el cilindre topogràfic, la transparència corneal, la neovascularització corneal i l’aparició de reaccions immunològiques i altres complicacions.
Resultats: La mitja de seguiment va ser de 16 mesos. L’agudesa visual postoperatòria amb i sense correcció va ser significativament millor que els valors registrats en el preoperatòri.
No s’observen diferències estadísticament significatives respecte l’astigmatisme durant el seguiment. La transparència de l’empelt va romandre estable en 17 ulls (63%). En la majoria dels casos (89%) es va observar una reducció de la densitat de la vascularització corneal i la modificació del seu trajecte degut a la presencia de l’anell de Krumeich. En quant a les reaccions immunològiques, van ser descrites en 6 ulls (22%) i només un ull va derivar en una fallada de l’empelt. Les altres complicacions postoperatòries que van tenir lloc van ser 2 descompensacions de l’empelt, 2 infeccions, 1 recurrència per virus herpes simple i una extrusió de l’anell.
Conclusió: La col•locació de l’anell intraestromal metàl•lic de Krumeich és una opció segura i eficaç en queratoplàsties penetrants d’alt risc potenciant la supervivència de l’empelt, així com disminuint l’aparició de reaccions immunològiques i inhibint la neovascularització corneal.
ABSTRACT
Purpose: To describe the clinical outcomes of penetrating keratoplasty with Krumeich intrastromal corneal ring implantation in high-risk corneas.
Methods: We reviewed the charts of twenty-seven eyes of 26 patients who were considered high-risk recipients and who underwent penetrating keratoplasty with Krumeich intrastromal corneal ring implantation. Main outcomes studied were visual acuity, astigmatism, corneal transparency, corneal neovascularization, occurrence of immune reactions and complications.
Results: Mean follow-up time was 16 months. Postoperative uncorrected and best corrected visual acuities significantly improved from preoperative values. No significant changes in astigmatism were observed during the follow-up period. Graft transparency was maintained in 17 eyes (63%) throughout follow-up. Vessels growing into the graft were deflected by the presence of the Krumeich ring in almost all cases (89%). Immune rejection developed in 6 eyes (22%) with only 1 eye progressing to graft failure. Other complications included 2 graft decompensations, 2 graft infections, 1 herpes simplex virus recurrence in graft and 1 ring extrusion.
Conclusion: Krumeich intrastromal corneal ring implantation is a safe and effective adjunct in high-risk penetrating keratoplasty that can potentially increase graft survival by reducing immune reactions and inhibiting graft neovascularization.
Methods: We reviewed the charts of twenty-seven eyes of 26 patients who were considered high-risk recipients and who underwent penetrating keratoplasty with Krumeich intrastromal corneal ring implantation. Main outcomes studied were visual acuity, astigmatism, corneal transparency, corneal neovascularization, occurrence of immune reactions and complications.
Results: Mean follow-up time was 16 months. Postoperative uncorrected and best corrected visual acuities significantly improved from preoperative values. No significant changes in astigmatism were observed during the follow-up period. Graft transparency was maintained in 17 eyes (63%) throughout follow-up. Vessels growing into the graft were deflected by the presence of the Krumeich ring in almost all cases (89%). Immune rejection developed in 6 eyes (22%) with only 1 eye progressing to graft failure. Other complications included 2 graft decompensations, 2 graft infections, 1 herpes simplex virus recurrence in graft and 1 ring extrusion.
Conclusion: Krumeich intrastromal corneal ring implantation is a safe and effective adjunct in high-risk penetrating keratoplasty that can potentially increase graft survival by reducing immune reactions and inhibiting graft neovascularization.
Introducción
A pesar de los numerosos avances en inmunosupresión e inmunomodulación, la queratoplastia penetrante de alto riesgo sigue siendo un desalentador y difícil reto para los cirujanos de segmento anterior. La tasa de éxito en comparación con la tasa de supervivencia del injerto a los dos años en los casos sin complicaciones, ni neovascularización y de bajo riesgo, es de más del 90%1,2. “The Collaborative Corneal Transplantations Studies (CCTS)” describen una tasa de éxito del 65% o menor a los 3 años3. Streilein et al, reportan una tasa de éxito menor del 50% a los dos años4.El rechazo del aloinjerto corneal sigue siendo la principal causa de fallo del injerto. El rango de rechazo en receptores de alto riesgo se encuentra entre el 50 y 70%1,5,6. La neovascularización corneal (NVC) es un factor importante que incrementa el riesgo de rechazo inmunológico. La presencia de la vascularización corneal modifica el medio quimotáctico y promueve el reclutamiento e infiltración de células efectoras inmunes dentro del aloinjerto, realzando así la rama eferente de la respuesta inmune. El CCT no logró demostrar una asociación significativa entre la NVC y el rechazo inmune pero fue capaz de mostrar la existencia de un doble riesgo de fallo del injerto en corneas que presentaban vascularización estromal en los cuatro cuadrantes3. Bachmann et al. reportan un metanálisis de 19 estudios con un total de 24.944 queratoplastias penetrantes, y confirman que la presencia de NVC preoperatoria dobla significativamente el riesgo de rechazo del injerto e incrementa el riesgo de fallo en el futuro en un 32%7. También demostraron que el riesgo para ambos, fallo y rechazo del injerto, incrementa progresivamente con el número de cuadrantes corneales afectados. Fue descrito también en estudios previos por Khodadoust, Hill, Gibbs y Thompson8. La NVC postoperatoria ha sido implicada como un factor de riesgo para el fallo del injerto en múltiples estudios. Así lo confirman Sit et al. reportando más del doble de riesgo de fallo del injerto en casos de invasión vascular postoperatoria en el aloinjerto9. Éstos hallazgos enfatizan la necesidad de estudiar e investigar opciones de tratamiento anti-angiogénico para mejorar la supervivencia de los injertos corneales ya sea condicionando previamente el lecho receptor o inhibiendo el ataque inmunológico en el injerto.
La terapia corticoidea permanece en el pilar del tratamiento médico para la supresión del crecimiento de los vasos corneales. Otros tratamientos médico anti-angiogénicos que han sido probados con éxito en humanos incluyen ciclosporina A tópica y sistémica, tacrolimus (FK-506) tópico y sistémico10 y rapamicina. Varios estudios han demostrado exitosamente el tratamiento para la neutralización del factor de crecimiento vascular endotelial (VEGF) mediante bevacizumab tópico11, subconjuntival12, perilimbar o intraestromal13.
En cuanto a estrategias quirúrgicas que se han utilizado para el tratamiento de la NVC establecida se incluyen: la fotoablación con láser argón, la electrocoagulación, la terapia fotodinámica y la restauración de la superficie ocular con transplante de conjuntiva, limbo o membrana amniótica14.
En 2006, Krumeich y Duncker describieron el potencial inhibitorio y el efecto barrera del anillo intraestromal metálico corneal (ISCR) implantado en queratoplastias penetrantes (QP) para evitar la neovascularización corneal15. Éste anillo fue diseñado con la finalidad de reducir el astigmatismo postoperatorio y fue descrito por primera vez en 1999 en 179 pacientes que fueron sometidos a una queratoplastia penetrante por queratocono y otras ectasias, distrofias y leucomas corneales de diferentes etiologías. En éste estudio constataron, que la aparición de vascularización superficial era frenada por el anillo y que los vasos no crecían hacia el injerto.
Además, también observaron reacciones inmunológicas en tan solo 5 ojos (2.8%) en comparación con 7 de los 101 ojos (7%) en 5 años, que fueron sometidos a QP sin anillo. Por otro lado, encontraron una reducción significativa en cuanto al fallo del injerto cuando compararon ambos grupos. Birnbaum et al. realizaron un estudio similar en pacientes con distrofia endotelial de Fuchs y queratocono, compararon 10 ojos que fueron intervenidos de QP y implante de ISCR con 10 ojos que sólo fueron intervenidos de QP. Contrariamente a los hallazgos previos, vieron que existía una tasa de reacción inmunológica mayor en el grupo en el que se implantó el anillo (30%) comparado con el grupo control16. En éste estudio no tuvieron en cuenta el efecto del anillo respecto a la neovascularización del injerto.
Nosotros les presentamos los resultados clínicos y complicaciones de la implantación de éstos ISCR en pacientes receptores de alto riesgo operados de QP. Desde nuestro conocimiento, éste es el primer estudio que describe la combinación de ambos procedimientos, QP y ISCR, en pacientes con corneas de alto riesgo.
Material y métodos
Se trata de un estudio retrospectivo e intervencional, de una serie de 27 ojos de 26 pacientes (16 varones, 17 mujeres) que fueron sometidos a QP con implante de anillo intraestromal de Krumeich en el Centro de Oftalmología Barraquer durante febrero del 2008 y septiembre del 2010. El protocolo del estudio fue aprobado por el comité de ética e investigación de la misma institución. Todos los ojos incluidos fueron considerados de alto riesgo. Definimos “alto riesgo” como la presencia de vascularización estromal que invade la córnea un mínimo de 2 mm y que afecta a un mínimo de 2 cuadrantes, con o sin fallo de injerto previo3. Las características estudiadas de los pacientes receptores incluyen la etiología de la córnea original, el fallo del injerto previo y el grado de NVC preoperatoria.El tejido donante fue obtenido del banco de ojos de la misma institución. Prácticamente la mitad (48%) de las córneas fueron recogidas de globos frescos. En cuanto a las córneas conservadas, el intervalo de tiempo entre la preservación y el trasplante fue de 2.5 ± 1.9 días (media ± (desviación estándar (DE)) (rango: 2.1 horas a 6.8 días). El contaje endotelial medio fue de 2720 ± 305 células/mm2 (rango: 2188 a 3448 células/mm2).
El anillo de Krumeich (Human Optics AG, Erlangen, Germany) es un anillo metálico biocompatible, compuesto por cobalto (Co) (69.5%), cromo (Cr) (24.0%), molibdeno (Mo) (4.5%) y titanio (Ti) (2%), con un diámetro de 8.0 mm (diámetro externo: 8.1 mm, diámetro interno: 7.95 mm) y un grosor de 0.15 mm ± 0.02 mm.
Todas las cirugías fueron realizadas por el mismo cirujano, especialista y experimentado en cirugía del segmento anterior utilizando la técnica descrita por Sauvageot y Álvarez de Toledo17.
Diez de los 27 ojos fueron sometidos a cirugía de cristalino y/o superficie ocular. Dos ojos recibieron una inyección subconjuntival de bevacizumab (Avastin) y otros dos ojos recibieron tanto una inyección subconjuntival como intracorneal de bevacizumab. El ojo operado fue ocluido mediante un vendaje durante las primeras 24 horas. El régimen estándar que se siguió en el postoperatorio incluía tobramicina y dexametasona tópica (Tobradex®), colirio de cloruro de sodio al 5%, lágrimas artificiales y prednisona oral (Dacortin®). Los pacientes que tenían antecedentes personales previos de herpes ocular, además fueron tratados de modo profiláctico con aciclovir oral (Zovirax®) o famciclovir (Famvir®).
Las variables principales evaluadas en éste estudio fueron la agudeza visual, el astigmatismo, la transparencia del injerto, la aparición de rechazo inmunológico y el crecimiento vascular en el primer, tercer, sexto y duodécimo mes de seguimiento. También se tuvieron en cuenta las complicaciones. El éxito del injerto fue definido como el mantenimiento de la transparencia suficiente para conseguir una visión adecuada.
El análisis estadístico fue realizado utilizando el software SPSS 13.0 para Windows (SPSS, Chicago, Illinois, USA). Se procedió a realizar la evaluación de las variables y comparación de las mismas utilizando el test estadístico Wilcoxon T para muestras pareadas. Las diferencias fueron consideradas significativas cuando el valor de P era < 0.05.
Resultados
La edad media fue de 50 ± 24 años con un rango entre 4 y 81 años. EL promedio de seguimiento fue de 16 ± 9.8 meses (rango: 2 y 37 meses). La indicación para la cirugía en la mayoría de los casos fue por la presencia de una cicatriz corneal post herpética. Diecinueve de los 27 ojos (70%) presentaban en el preoperatorio, al menos dos cuadrantes con NVC profunda; los 8 ojos restantes presentaban un fallo previo del injerto (Tabla 1). Hubo once ojos que presentaban historia de glaucoma y sólo tres con historia de uveítis. Diecisiete ojos (63%) habían sido intervenidos previamente (5 QP, 1 cirugía del cristalino, 11 QP combinada con cirugía de superficie ocular y/o glaucoma y/o cirugía del segmento posterior).
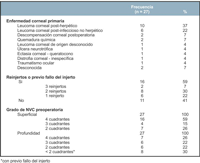
Tabla 1. Resumen de los factores de riesgo de los ojos estudiados.
La agudeza visual no corregida (AVSC) media, previa a la cirugía, fue de 2.08 ± 0.56 logMAR. Al primer mes, fue de 1.27 ± 0.34 logMAR, a los 3 meses de 1.34 ± 0.41 logMAR, a los 6 meses de 1.21 ± 0.60 logMAR y a los 12 meses de 0.89 ± 0.43 logMAR.
La mejor agudeza visual corregida (MAVC) media, previa a la cirugía, fue de 2.00 ± 0.63 logMAR. Al primer mes, fue de 0.99 ± 0.38 logMAR, a los 3 meses de 0.87 ± 0.39 logMAR, a los 6 meses de 0.75 ± 0.60 logMAR y a los 12 meses de 0.53 ± 0.50 logMAR. La Figura 1 muestra los cambios de la agudeza visual en el tiempo. Hubo una mejoría significativa de la MAVC comparando los valores pre y postquirúrgicos en 8 líneas al primer mes (P = 0.004), 9 líneas a los 3 meses (P = 0.001), 11 líneas a los 6 meses (P = 0.001) y 15 líneas a los 12 meses (P = 0.005).
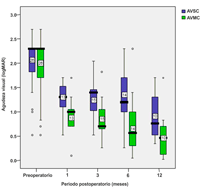
Figura 1. Cuadro gráfico que muestra la tendencia de la agudeza visual en el tiempo.
El astigmatismo medio previo a la cirugía fue de -4.50 ± 4.21 D, al primer mes fue de -6.11 ± 2.80 D, a los 3 meses de -5.35 ± 3.71 D, a los 6 meses de -4.83 ± 2.75 D y a los 12 meses de -4.94 ± 3.45 D. La Figura 2 muestra los cambios del astigmatismo durante el periodo de seguimiento.
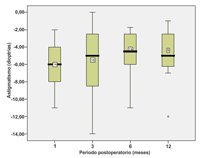
Figura 2. Cuadro gráfico que muestra los cambios en el astigmatismo durante el periodo de seguimiento.
17 de los 27 injertos corneales (63%) permanecieron transparentes durante todo del seguimiento. En la mayoría de los injertos hubo una desviación de la invasión vascular en el injerto (89%) debido a la presencia del anillo de Krumeich (Figura 3).
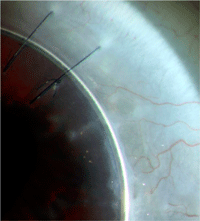
Figura 3. Imagen tomada de la lámpara de hendidura que muestra la desviación de los vasos por el anillo de Krumeich. Los nuevos vasos son desviados hacia la interfase donante-receptor dónde ejecutan su curso paralelamente y cerca del mismo anillo.
6 de los 27 ojos (22%) experimentaron reacciones inmunes, presentando línea de Khodadoust o edema corneal difuso. La indicación primaria para la cirugía en éste tipo de ojos incluía; leucoma corneal post-herpético, cicatriz corneal postinfecciosa (de origen no herpético), queratocono avanzado y distrofia corneal inespecífica.
En todos los pacientes que presentaron episodios de rechazo, éstos fueron revertidos entre los 2 y 4 meses tras iniciar tratamiento agresivo con terapia corticoidea, excepto en el caso de una mujer de 65 años, con antecedentes de cirugía previa de glaucoma y dos injertos previos fallidos. El rechazo de su injerto fue progresivo y actualmente está pendiente de realizar una cirugía de queratopróstesis. Se observó que la dosis de prednisona oral fue interrumpida prematuramente durante el periodo postoperatorio intermedio por la contraindicación de la toma de la misma.
No observamos ningún caso de NVC en los rechazos excepto en un caso, donde el tratamiento corticoideo tópico a largo plazo fue suspendido sin el consentimiento del oftalmólogo (Figura 4). A pesar de la disminución de la AV con el tiempo debido a los episodios de rechazo descritos en éste grupo de pacientes, la AVSC y la MAVC incrementaron significativamente comparado con la AV preoperatoria mejorando de 3 a 13 líneas.
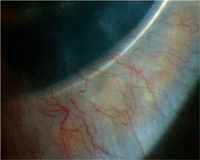
Figura 4. Imagen en la lámpara de hendidura que muestra la invasión vascular a través del anillo de Krumeich durante un episodio de rechazo prácticamente a los 3 años del postoperatorio, en una mujer de 79 años con historia previa de enfermedad corneal herpética y un fallo del injerto.
2 de los 27 ojos (7%) sufrieron una descompensación del injerto. El primer caso fue una mujer de 81 años, con historia previa de glaucoma, afaquia y múltiples cirugías oculares previas (3 QP, 1 cirugía de cristalino) y posteriores (cirugía de vítreo-retina con inyección de aceite de silicona debido a una hemorragia subcoroidea) se le realizó una QP con implante de anillo de Krumeich juntamente con otros procedimientos (implante de lente intraocular secundario, vitrectomía) durante la misma cirugía. La presión intraocular (PIO) no logró controlarse con tratamiento tópico y tuvieron que realizarle una sesión de láser de diodo transescleral que derivó en fallo endotelial y posterior edema del injerto. El segundo caso fue un chico de 8 años con antecedentes de traumatismo ocular que presentaba múltiples cicatrices corneales. La PIO tampoco pudo ser controlada, presentando finalmente un edema persistente del injerto y tuvo que ser reoperado de QP con implante intraestromal de anillo de Krumeich un año después. En el último mes de seguimiento, el nuevo injerto permanecía transparente y con la PIO controlada.
En el estudio, tuvimos dos casos que presentaron infección del injerto (7%). Uno de ellos fue una mujer de 33 años, con historia de enfermedad corneal herpética y dos injertos fallidos previos por rechazo, que un año más tarde derivó en un absceso en la sutura localizada a la 1 horas. La infección se resolvió a las dos semanas sin secuelas tras intenso tratamiento tópico con vancomicina y gentamicina. El segundo caso, un varón de 53 años que previamente había sufrido un fracaso tras una queratoplastia debido a una úlcera neurotrófica y a su pobre higiene. Éste paciente tuvo 4 episodios de infección para 3 diferentes tipos de bacterias (Staphylococcus aureus, Klebsiella oxytoca y Staphylococcus aureus resistente a la ceftacidima) en los últimos 11 meses.
La última infección, resistente al tratamiento intensivo tópico con ceftacidima y amikacina, apareció un mes y medio más tarde (Figura 5). Debido a la recurrencia de las infecciones y a la persistente úlcera corneal con necrosis que padecía, se decidió reintervenir al paciente con una nueva queratoplastia con anillo de Krumeich junto con una inyección subconjuntival de bevacizumab en el área donde se hallaban los vasos.
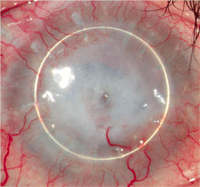
Figura 5. Imagen de la córnea de un paciente durante el cuarto episodio de queratitis bacteriana 2 años después de la cirugía, presentando un melting estromal corneal, perforación central e invasión vascular que atravesó el anillo.
El injerto permaneció transparente y libre de infección durante el resto de seguimiento.
Un caso de recurrencia de virus herpes simple (VHS) en el nuevo injerto, fue descrito en una mujer de 23 años de edad que había sido intervenida por un leucoma corneal post-herpético con abundante neovascularización (superficial y profunda NV en los 4 cuadrantes). Tuvo dos episodios de queratitis epitelial, a los 9 y 16 meses postoperatorios, que se resolvieron dejando un adelgazamiento corneal central junto a una invasión de vasos superficiales que atravesaban el anillo en su área inferotemporal. A pesar de todo, la MAVC mejoró en 10 líneas comparado con la AV en el preoperatorio.
Un caso de exposición del anillo fue observado en un paciente de 4 años de edad, sometido a cirugía tras una cicatriz corneal postinfecciosa con alto grado de afectación vascular (superficial y profunda en los 4 cuadrantes). Nueve días después de la cirugía se observó una colocación poco profunda del anillo de Krumeich en el área superonasal (Figura 6). Poco a poco hubo una extrusión progresiva del anillo hasta que a los 20 meses tuvo que ser explantado. Su AV mejoró en 11 líneas respecto a la AV antes de la cirugía.
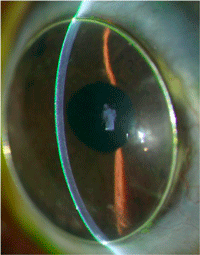
Figura 6. Imagen en la que se observa una extrusión del anillo de Krumeich. A destacar, la colocación superficial del mismo en el área superior comparando con el área inferior.
Discusión
La restauración de la visión en córneas ciegas a través de la QP puede ser alcanzable incluso en córneas de alto riesgo. En el presente estudio hay un incremento estadísticamente significativo de ambas AV, con y sin corrección, comparando los valores preoperatorios y postoperatorios. En los casos en que el injerto fue rescatado de una complicación pero tuvo una disminución de la visión durante el curso postoperatorio, la visión final fue siempre mejor que la visión antes de la QP.Similar a otros estudios previos, dónde la utilidad del implante del anillo intraestromal en cuánto a la reducción del astigmatismo no fue probado, no encontramos diferencias estadísticamente significativas entre el astigmatismo antes y después de la QP. La estabilidad postoperatoria en la refracción con el anillo fue del mismo modo no observada. Krumeich y Duncker no describieron cambios en la refracción postoperatoria independientemente de la presencia de las suturas en pacientes en los que se implantó el anillo y solamente hubo cambios de 1 D a intervalos de un mes en los pacientes en los que no se había implantado el anillo (15). En ésta serie de casos, se observaron mayores cambios, de 3 D, entre intervalos de 3 a 6 meses durante el periodo postoperatorio pero éstos no fueron estadísticamente significativos.
La transparencia del injerto es un punto clave para el éxito de la QP. Sin embargo esto está bajo riesgo constante en casos de alto riesgo dónde la incidencia de rechazo inmune y la invasión de los vasos son mayores. En éste estudio, el 63% de los ojos mantuvieron una transparencia del injerto durante todo el periodo de seguimiento, con tan solo un caso de fracaso del injerto (4%). Ésta tasa es mucho mayor que la tasa de rechazo de 2.8% a los 5 años que fue reportada por Krumeich y Duncker en pacientes que se sometieron a la misma cirugía combinada. Sin embargo, hay que destacar que la mayoría de los ojos incluidos en su estudio no presentaban características de alto riesgo y ninguno de esos ojos presentaba NVC en más de 2 cuadrantes. La tasa de rechazo observada en este estudio fue también menor al estudio publicado por Birnbaum et al (30%) en el que realizó la misma intervención en receptores de bajo riesgo. En este estudio, se hallaron reacciones inmunes ya desde los 4 meses y hasta los 3 años después de la cirugía, en contraste con los resultados anteriores descritos por Krumeich y Duncker donde ojos con ISCR experimentaron reacciones inmunes sólo durante los primeros 6 meses después de la cirugía.
El mecanismo exacto por el que el anillo ejerce sus efectos inhibidores inmunes todavía no está claro. Krumeich y Duncker mostraron en investigaciones in vitro previas sobre los ISCR, que con la utilización de una reacción de linfocitos mixta (MLC), aparecía una reducción significativa de la liberación de interferón (IFN)-γ comparando con el grupo control15. Múltiples estudios in vitro e in vivo sobre los componentes metálicos similares a los que comprenden el anillo de Krumeich, han demostrado que estos metales pueden deteriorar la respuesta inmune y modular la expresión de las citoquinas. Faleiro et al. informaba que la combinación de Co-Cr-Mo inhibía la proliferación in vitro de linfocitos T en sangre humana17.
Wang et al. demostraron que Co, Cr y Ti inhibían significativamente la fitohemaglutinina (PHA)- inducida por la proliferación celular T y también el lipopolisacárido- inducido por la proliferación celular B y la liberación de interleuquina (IL)-2 y IL-6 a través de la estimulación de PHA y células mononucleares de la sangre periférica (PBMC). Ellos también mostraron que Co y Cr reducían significativamente el IFN-γ liberado por el PHA, a su vez, estimulado por la PBMC18,19.
Se observó la invasión vascular en el injerto una vez implantado el anillo en tan solo 3 ojos (11%) que, a su vez, habían sufrido complicaciones. En la mayoría de los casos, incluyendo algunos que experimentaron reacciones inmunes o infección del injerto, se detectó la misma observación que Krumeich y Duncker – que los vasos que crecen radialmente son desviados del anillo y ejecutan un curso por fuera, aunque cerca y paralelo al mismo anillo.
La tasa global de éxito del injerto en este estudio, con receptores de alto riesgo, fue del 85%. Es mucho mayor que los descritos en la literatura, que varían desde menos del 50% al 65%.
En conclusión, los resultados clínicos en ésta serie de casos mostraron que la implantación del anillo de Krumeich es un coadyuvante seguro y viable en trasplantes de córnea de alto riesgo. Y que, potencialmente puede aumentar la supervivencia del injerto mediante la reducción de las reacciones inmunes e inhibir la neovascularización del injerto. Los beneficios de la utilización de ésta nueva técnica son muy superiores a sus complicaciones.
Bibliografía
- Fink N, Stark WJ, Maguire MG, et al. Effectiveness of histocompatibility matching in high-risk corneal transplantation: a summary of results from the Collaborative Corneal Transplantation Studies. Cesk Oftalmol. 1994;50:3-12.
- Price FW, Jr., Whitson WE, Collins KS, Marks RG. Five-year corneal graft survival. A large, single-center patient cohort. Arch Ophthalmol. 1993;111:799-805.
- Maguire MG, Stark WJ, Gottsch JD, et al. Risk factors for corneal graft failure and rejection in the collaborative corneal transplantation studies. Collaborative Corneal Transplantation Studies Research Group. Ophthalmology. 1994;101:1536-47.
- Streilein JW, Yamada J, Dana MR, Ksander BR. Anterior chamber-associated immune deviation, ocular immune privilege, and orthotopic corneal allografts. Transplant Proc. 1999;31:1472-5.
- Chong EM, Dana MR. Graft failure IV. Immunologic mechanisms of corneal transplant rejection. Int Ophthalmol. 2008;28:209-22.
- Hamrah P. High-risk penetrating keratoplasty. Arch Soc Esp Oftalmol. 2005;80:5-7.
- Bachmann B, Taylor RS, Cursiefen C. Corneal neovascularization as a risk factor for graft failure and rejection after keratoplasty: an evidence-based meta-analysis. Ophthalmology. 2010;117:1300-5.
- Thompson RW, Jr., Price MO, Bowers PJ, Price FW, Jr. Long-term graft survival after penetrating keratoplasty. Ophthalmology. 2003;110:1396-402.
- Sit M, Weisbrod DJ, Naor J, Slomovic AR. Corneal graft outcome study. Cornea. 2001;20:129-33.
- Dhaliwal JS, Mason BF, Kaufman SC. Long-term use of topical tacrolimus (FK506) in high-risk penetrating keratoplasty. Cornea. 2008;27:488-493.
- Dastjerdi MH, Al-Arfaj KM, Nallasamy N, et al. Topical bevacizumab in the treatment of corneal neovascularization: results of a prospective, open-label, noncomparative study. Arch Ophthalmol. 2009;127:381-9.
- Dastjerdi MH, Saban DR, Okanobo A, et al. Effects of topical and subconjunctival bevacizumab in high-risk corneal transplant survival. Invest Ophthalmol Vis Sci. 2010;51:2411-17.
- Bachmann BO, Bock F, Wiegand SJ, et al. Promotion of graft survival by vascular endothelial growth factor a neutralization after high-risk corneal transplantation. Arch Ophthalmol. 2008;126:71-7.
- Chang JH, Gabison EE, Kato T, Azar DT. Corneal neovascularization. Curr Opin Ophthalmol. 2001;12:242-249.
- Krumeich JH, Duncker G. Intrastromal corneal ring in penetrating keratoplasty: evidence-based update 4 years after implantation. J Cataract Refract Surg. 2006;32:993-8.
- Birnbaum F, Schwartzkopff J, Bohringer D, Reinhard T. The Intrastromal Corneal Ring in Penetrating Keratoplasty-Long-term Results of a Prospective Randomized Study. Cornea. 2011;30:780-83.
- Sauvageot P, Alvarez de Toledo J. Implante de anillo intraestromal de Krumeich en queratoplastia penetrante. Annals d´Oftalmologia. 2010;18(4):200-2.
- Wang JY, Tsukayama DT, Wicklund BH, Gustilo RB. Inhibition of T and B cell proliferation by titanium, cobalt, and chromium: role of IL-2 and IL-6. J Biomed Mater Res. 1996;32(4):655-61.
- Wang JY, Wicklund BH, Gustilo RB, Tsukayama DT. Prosthetic metals impair murine immune response and cytokine release in vivo and in vitro. J Orthop Res. 1997;15(5):688-99.

