
Volumen 22 - Número 5 - Diciembre 2014
Biomicroscopía ultrasónica
C. Salinas
Institut de Microcirurgia Ocular. Barcelona.
CORRESPONDENCIA
Cecilia Salinas
E-mail: salinas@imo.es
E-mail: salinas@imo.es
Introducción
En los últimos años, con el advenimiento de la interferometría y el láser de luz superluminiscente, se han desarrollado numerosos avances tecnológicos para el diagnóstico en oftalmología. Sin embargo, estas técnicas de imagen no permiten atravesar medios opacos, por lo que la ecografía continúa siendo una herramienta esencial en la práctica clínica habitual.Las frecuencias ultrasónicas usadas en oftalmología han sido generalmente mayores que las empleadas en medicina general, debido a que en el ojo no se requiere gran capacidad de penetración, pero sí un alto poder de resolución. La mayor parte de los equipos de ultrasonidos usan frecuencias del rango de 10 MHz. El uso de frecuencias entre 35 y 100 MHz es relativamente nuevo en esta especialidad y permite obtener imágenes del segmento anterior del ojo hasta la pars plana.
A esta última modalidad de examen se la denomina biomicroscopía ultrasónica (BMU) por su similitud con la biomicroscopía óptica. La habilidad de observar los tejidos en vivo, por debajo de la superficie ocular y con resolución microscópica, provee un nuevo camino para el estudio de la patología ocular1.
Instrumentación y técnica
Los componentes esenciales de esta producción de imagen son similares a los de la ecografía en modo B convencional, pero la frecuencia de operación es de alta magnitud. El transductor tiene un movimiento lineal, la onda sonora es transmitida a los tejidos y el eco es recibido por el mismo transductor. La señal acústica se amplifica en proporción a la profundidad a la que se ha originado, siendo luego convertida a un formato digital analógico y transferida a la pantalla del ordenador1.Antes de realizar la prueba conviene explicar el procedimiento, ya que se trata de una técnica no invasiva, pero tiene contacto con el ojo y puede producir mínimas molestias.
El paciente debe ser examinado en posición supina, en una camilla o un sillón reclinable. El monitor se colocará en altura. El operador tiene que situarse a la cabeza del paciente, de modo que pueda visualizar el ojo, la posición de la sonda y la pantalla del ordenador simultáneamente.
La técnica preferida es de inmersión. Se coloca, previa instilación de gotas anestésicas, una copa ocular de exploración. Las copas más adecuadas son las de silicona, ya que son muy blandas y maleables, con diferentes medidas de base y esta de bordes romos. Se instila metilcelulosa solo en la base y se rellena con solución fisiológica (Figura 1a).

Figura 1. a) Técnica de inmersión con copa de silicona; en su interior, solución fisiológica. Nótese la mínima presión que debe realizarse para evitar molestias. b) ClearScan, adaptador para la sonda.
Una buena opción para pacientes poco colaboradores es ClearScan. Consiste en un adaptador para la sonda con una película muy delgada que es acústicamente invisible; debe introducirse solución fisiológica en su interior. Este dispositivo puede apoyarse sobre la córnea y la conjuntiva (Figura 1 b).
Las mejores imágenes se obtienen cuando el haz de ultrasonidos es perpendicular al sitio que va a ser explorado. La perpendicularidad se obtiene con pequeños movimientos del ojo del paciente y de la sonda. El número de posibilidades de orientación de la sonda es grande, y puede moverse en dirección vertical, horizontal, inclinada o rotada. Es de ayuda que el paciente mire hacia el sitio de la patología2.
Una marca en la sonda indica el plano de movimiento del transductor. Esta marca coincide con el lado izquierdo de la imagen en el monitor.
Hay dos formas de posición de la sonda:
- Radial (la más común): la marca de la sonda se coloca sobre el limbo en dirección a la esclera.
- Transversa, a 90º de la posición radial: la sonda se coloca paralela al limbo.
Indicaciones
La BMU es una técnica no invasiva útil para la visualización de las relaciones anatómicas de las estructuras del segmento anterior. La integridad del iris y el ángulo iridocorneal, la cámara posterior, la zónula, el cristalino, el cuerpo ciliar, la pars plana y la extrema periferia de la retina pueden analizarse con detalle. Permite estudiar la posición de las lentes intraoculares en caso de inflamaciones crónicas, traumatismos y tumores. Y merece una mención especial su utilidad para valorar los sitios de las eclerotomías en pacientes con hemorragias persistentes posvitrectomía.La UBM en la inflamación pseudofáquica crónica
La cirugía de cataratas ha evolucionado en pocas décadas; los avances en las técnicas de facoemulsificación, el diseño de nuevas lentes y el desarrollo de novedosos materiales han llevado al éxito de la cirugía en la mayoría de los pacientes. Las complicaciones relacionadas con la posición de las lentes ocurren ocasionalmente. Cuando se rompe la cápsula, la colocación en sulcus es una opción, y con frecuencia es difícil la determinación precisa de la colocación del háptico en el sulcus.El roce o la erosión en el iris pueden ocurrir particularmente con pequeños desplazamientos del háptico, los cuales llevan a una inflamación postoperatoria crónica inducida por la LIO.
La BMU es la única técnica que permite visualizar las lentes intraoculares en vivo y determinar la relación de estas con las estructuras adyacentes. Las márgenes de la óptica pueden ser perfectamente vistas, ya que son muy reflectivas en su superficie anterior y posterior. Para el estudio de los hápticos debe hacerse un corte radial en los cuatro cuadrantes, tratando de encontrar un trazado con alta reflectividad y reverberaciones. En la posición correcta en el saco capsular, los hápticos se observan en la región medial frente a los procesos ciliares3.
El síndrome uveítis-glaucoma-hipema (UGHS), descrito por Ellingson en 19784, es una infrecuente pero bien reconocida complicación de la cirugía de catarata, asociada a lentes intraoculares de cámara anterior. Con la declinación del uso de estas lentes, muchos casos de UGHS están asociados a lentes intraoculares de cámara posterior. Este síndrome típicamente implica el contacto entre la lente intraocular y el epitelio pigmentario del iris o el cuerpo ciliar, y la uveítis ocasionada como resultado de este contacto. La fijación al sulcus inestable o el movimiento excesivo causan la rotura de la barrera sangre-acuoso. Rozaduras posteriores del iris por hápticos pueden producir un espectro de trastornos que incluyen defectos del epitelio pigmentario del iris (efecto ventana), dispersión de pigmento con o sin aumento de la presión intraocular, hipema intermitente con oscurecimientos visuales transitorios, uveítis e incluso hemorragias vítreas. La BMU ayuda a confirmar la sospecha de pequeños desplazamientos de los hápticos y a visualizar el contacto con el epitelio pigmentario del iris, el cuerpo ciliar o la zónula3-5 (Figura 2).
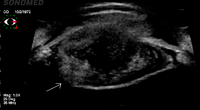
Figura 2. Traumatismo contuso con hipema, desplazamiento anterior del cristalino y rotura de cápsula anterior y posterior (flecha).
Traumatismos
Los traumatismos contusos, penetrantes o perforantes a menudo conllevan anormalidades que son difíciles de evaluar por opacidades corneales, inflamación o hemorragia (Figura 3). La BMU es un excelente medio de exploración de las estructuras angulares, lo que supone una gran ayuda para valorar el daño angular secundario a un traumatismo:

Figura 3. a) Subluxación de LIO con roce de la óptica con el epitelio pigmentario del iris. El paciente consultaba por visión borrosa y presentaba un mínimo Tyndall hemático. b y c) Corte longitudinal y transverso de háptico enclavado en el sulcus, produciendo varios cuadros de hemovítreos leves de repetición.
- Recesión angular: es el desgarro del cuerpo ciliar, muchas veces ocasionado por la onda expansiva de un traumatismo contuso en su zona más anterior (entre la inserción en el espolón escleral y la raíz del iris), y no produce desinserción del espolón escleral. Con ultrasonidos se detecta, en la parte superficial, una línea hiperreflectiva que representa una condensación secundaria de tejido de cuerpo ciliar en la superficie1,2.
- Iridodiálisis: es el desgarro en la zona más delgada del iris, la raíz. La BMU revela un remanente de tejido adherido al espolón escleral1,2.
- Ciclodiálisis: es la desinserción del espolón escleral de la raíz del iris y generalmente el resultado es una hipotonía. La gonioscopia en ojos hipotónicos es muy difícil y solo puede verse la cara anterior de la hendidura. Con la BMU se visualiza con detalle la alteración anatómica descrita y la comunicación directa entre la cámara anterior y el espacio supraciliar a lo largo de toda su extensión longitudinal y circunferencial, con una evaluación precisa de su ubicación y tamaño6.
- Desprendimiento del cuerpo ciliar: puede ser consecuencia de ciclodiálisis o traccional por membrana ciclítica. El desprendimiento no se limita sólo a uno o dos cuadrantes; incluso si la causa se localiza en una fina ciclodiálisis, el fluido se extiende porque el espacio supraciliar es continuo. El líquido puede variar en grosor, pero siempre se presenta en los 360º. En la imagen ecográfica puede identificarse una línea hipoecogénica que separa el cuerpo ciliar de la esclera, atravesada por finas líneas de ecogenicidad media1-6 (Figura 4).
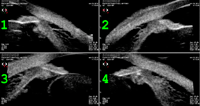
Figura 4. Desprendimiento de cuerpo ciliar en los cuatro cuadrantes.
- Membrana ciclítica: se extiende desde la pars plana hacia el espacio retrolental. Contiene elementos contráctiles que traccionan del cuerpo ciliar y causan desprendimiento. Debido a su localización, es muy difícil detectarla por métodos tradicionales de examen clínico. En la imagen con BMU se observa una membrana gruesa altamente hiperecogénica detrás del iris que cubre el cuerpo ciliar produciendo una pérdida de la integridad de la arquitectura normal7 (Figura 5).

Figura 5. Membrana ciclítica. Imagen densa de alta reflectividad desde la pars plana hacia el epitelio pigmentario del iris, que produce tracción y fino desprendimiento ciliocoroideo. Hay una desestructuración completa de la anatomía normal del cuerpo ciliar.
- Evaluación de la zónula: la apariencia ecográfica normal de la zónula es de unas finas líneas de reflectividad media que se extienden desde los procesos ciliares hasta la superficie del cristalino1,2 (Figura 6).

Figura 6. Fibras zonulares. Flecha grande: fibras zonulares anteriores desde el cuerpo ciliar hasta la superficie del cristalino. Flecha pequeña: fibras zonulares posteriores desde la pars plana hacia la superficie del cristalino.
- Cuerpos extraños: muchas veces se localizan en el ángulo y se cubren de tejido. Son muy difíciles de ver por gonioscopia y por ecografía convencional. La BMU muestra una imagen hiperecogénica con sombra posterior, y es un excelente método para la detección previa a la cirugía1 (Figura 7).

Figura 7. Cuerpo extraño. a) Cuerpo extraño metálico enclavado en la esclera. Nótese la reverberación de los ecos. b) Cuerpo extraño metálico en la pars plana, hora 5. Pueden medirse la distancia y el tamaño.
- Tumores de iris y cuerpo ciliar
- Quistes: pueden encontrarse en relación con el iris o el cuerpo ciliar. Al examen con lámpara de hendidura, se sospecha la presencia de pequeñas sobreelevaciones del iris. Con la BMU pueden verse lesiones bien definidas de forma redonda u oval, hipoecogénicas y con sus paredes hiperecogénicas. Cuando son múltiples y localizados en la raíz del iris, empujan hacia la cámara anterior cerrando el ángulo, lo que se denomina “iris pseudoplateau” (Figura 8 a y b). Cuando adquieren grandes dimensiones pueden desplazar estructuras adyacentes y simular un melanoma8 (Figura 8c).
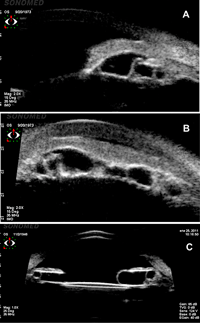
Figura 8. Quistes de cuerpo ciliar, con paredes hiperreflectivas e interior hiporreflectivo. a) Corte longitudinal. B) Corte transverso, iris pseudoplateau. c) Gran quiste de cuerpo ciliar en ojo con lente intraocular que al dilatar la pupila simulaba un melanoma.
- Nevo de iris: se presentan como áreas focales de hiperpigmentación plana o levemente sobreelevada. La BMU se emplea para medir y seguir estas lesiones con sospecha de crecimiento9.
- Melanoma de iris: generalmente se presenta como un tumor nodular solitario. Las características clínicas de vascularización, ectropion uveal, distorsión pupilar, dispersión pigmentaria, catarata en sector y glaucoma no siempre están presentes. Con ultrasonidos puede estudiarse la ecogenicidad interna y sobre todo el compromiso del epitelio pigmentario, que indica malignidad9 (Figura 9).
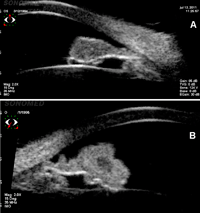
Figura 9. a) Nevo de iris con alta sospecha de melanoma. Se observa microvascularización interna, pero el epitelio pigmentario del iris está conservado y no hay afectación de las estructuras vecinas. b) Melanoma de iris, con rotura de la integridad del epitelio pigmentario del iris y centro hipoecogénico de vascularización interna.
-
Melanoma de cuerpo ciliar: se hace evidente cuando es suficientemente grande y causa síntomas o se extiende a la coroides anterior o al iris. La BMU permite medir la altura y la base con cortes longitudinales y transversos (Figura 10 y Figura 11), pero existen otras características ultrasonográficas importantes9:
- Interface tumor/cuerpo ciliar, con cambio en la reflectividad.
- Integridad del epitelio pigmentario del iris.
- Vascularización interna, que puede ser con dos patrones: a) puntos pequeños hiperecogénicos que se relacionan con vasos de pequeño calibre, o b) puntos grandes hipoecogénicos relacionados con grandes espacios vasculares (este último asociados a células fusiformes).
- Detección de los canales emisarios conectando con nódulos esclerales que sugieren invasión extraescleral.

Figura 10. Melanoma de cuerpo ciliar. a) Corte longitudinal. b) Corte transverso. Es posible diferenciar el tumor del área hiperreflectiva de la esclera y pueden realizarse medidas para su seguimiento.

Figura 11. Gran melanoma de cuerpo ciliar que invade las estructuras vecinas penetrando por canales emisarios a la esclera (a) y desplazando el cristalino (b). Es posible medir la altura y la base transversa, y también valorar la reflectividad interna (c).
Pars plana y retina periférica
El examen de la retina periférica y de la pars plana puede ser complicado. La visualización directa usando oftalmoscopía indirecta o biomicroscopía con lente de Goldman no siempre es la solución, sobre todo en ojos con dificultades para la dilatación pupilar o con medios opacos. La BMU proporciona una alta resolución de imagen en la pars plana y la retina periférica10.Se utiliza este método para estudiar la retinosquisis degenerativa, la retinosquisis ligada al cromosoma X, la retinopatía del prematuro, los desgarros periféricos, las diálisis retinales, los quistes de la pars plana, el síndrome de efusión coroidea y la uveítis, y para valorar el granuloma en la sarcoidosis, el síndrome de Vogt-Koyanagi-Harada y la pars planitis (Figura 12).

Figura 12. Pars planitis. Corte transverso y longitudinal sobre la pars plana que muestra una membrana fibroglial preretiniana. Se trata de los llamados “bancos de nieve”.
Tras una vitrectomía con buenos resultados, el hemovítreo continúa siendo una complicación común. El crecimiento fibrovascular que ocurre en los sitios de las eclerotomías es una situación clinicopatológica que puede ser causa de sangrado recurrente intravítreo posvitrectomía. La localización anatómica de este crecimiento fibrovascular es casi imposible de visualizar, pero con la BMU puede obtenerse una imagen característica de esta patología. Deben identificarse los sitios de las eclerotomías y realizar cortes ecográficos transversos y longitudinales. Las imágenes de estas lesiones pueden dividirse en tres grados11 (Figura 13):

Figura 13. Evaluación de los sitios de eclerotomía en un paciente vitrectomizado y con hemorragia. a) Corte longitudinal que muestra tejido hiperreflectivo en la pars plana con vítreo adherido. b) Misma imagen en corte transverso.
- Grado 0: sin aparente crecimiento fibrovascular, puede detectarse una disrupción focal de la capa del epitelio ciliar o una umbilicación focal de la pars plana.
- Grado 1: lesión elevada de tejido focal abovedado en la capa epitelial de la pars plana en el sitio de la esclerotomía.
- Grado 2: penacho vascular hiperecogénico con centro hipoecogénico y vítreo adherido (Figura 13).
Bibliografía
- Pavlin CJ, Foster FS. Ultrasound biomicroscopy of the eye. New York: Springer-Verlag; 1995.
- Sánchez Salorio M, García Feijóo J, Pazos González B. Biomicroscopía ultrasónica en oftalmología. Tecnimedia; 1998.
- Lima BR, Pichi F, Hayden BC, Lowder CY. Ultrasound biomicroscopy in chronic pseudophakic ocular inflammation associated with misplaced intraocular lens haptics. Am J Ophthalmol. 2014;157(4):813-7.e1. doi: 10.1016/j.ajo.2013.12.025.
- Ellingson FT. The uveitis-glaucoma-hyphema syndrome associated with the Mark VIII anterior chamber lens implant. J Am Intraocul Implant Soc. 1978;4:50-5.
- Scott Piette O, Canlas AQ, Viet Tran H, Ishikawa H, Liebmann JM, Ritch R. Ultrasound biomicroscopy in uveitis-glaucoma-hyphema syndrome. Am J Ophthalmol. 2002;133(6):839-41.
- Medeiros MD, Postorino M, Pallás C, Salinas C, Mateo C, Garcia-Arumí J, et al. Cyclodialysis induced persistent hypotony: surgical management with vitrectomy and endotamponade. Retina. 2013;33(8):1540-6. doi: 10.1097.
- Inazumi K, Gentile RC, Kelvin Y, Lee C, Ishikawa H, McCormick SA, et al. Ultrasound biomicroscopic diagnosis of cyclitic membranes. Am J Ophthalmol. 2001;131(4):446-50.
- Kunimatsu S, Araie M, Ohara K, Hamada C. Ultrasound biomicroscopy of ciliary body cysts. Am J Ophthalmol. 1999;127(1):48-55.
- Weisbrod DJ, Pavlin CJ, Xu W, Rand Simpson E. Long-term follow-up of 42 patients with small ciliary body tumors with ultrasound biomicroscopy. Am J Ophthalmol. 2010;149(4):616-22.
- Gentile RC, Berinstein DM, Liebmann J, Rosen R, Stegman Z, Tello C, et al. High-resolution ultrasound biomicroscopy of the pars plana and peripheral retina. Ophthalmology. 1998;105(3):478-84.
- Hershberger VS, Augsburger JJ, Hutchins RK, Raymond LA, Krug S. Fibrovascular ingrowth at sclerotomy sites in vitrectomized diabetic eyes with recurrent vitreous hemorrhage: ultrasound biomicroscopy findings. Ophthalmology. 2004;111(6):1215-21.

