
Volumen 22 - Número 5 - Diciembre 2014
Angiografía fluoresceínica en las uveítis posteriores
V. Llorens Bellés, M. Mesquida Febrer, A. Adán
Institut Clínic d’Oftalmologia (ICOF). Hospital Clínic. Barcelona.
CORRESPONDENCIA
Víctor Llorens Bellés
E-mail: Llorens.victor@gmail.com
E-mail: Llorens.victor@gmail.com
Introducción
La angiografía fluoresceínica (AGF) tiene un papel importante en las uveítis posteriores, tanto por su valor diagnóstico como por su aportación al manejo terapéutico. La AGF ayuda a establecer el grado de actividad inflamatoria, es útil en la monitorización de la respuesta al tratamiento y permite la detección del edema macular (EM), del desprendimiento seroso de la retina, de la neovascularización coroidea o de la retina, del grado y la extensión de la isquemia retiniana, y de la afectación del nervio óptico, que pueden acompañar a la inflamación intraocular.El uso de fluoresceína sódica como contraste para el estudio de la circulación retiniana es anterior a la década de 1950. En el año 1960, Maclean y Maumenee1 describieron la inyección intravenosa de fluoresceína en pacientes con tumores coroideos. Novotny y Alvis2, también en 1960, adaptaron y perfeccionaron el sistema retinográfico disponible para poder fotografiar secuencialmente el tránsito de la fluoresceína sódica a través de la retina, dando paso a lo que propiamente conocemos como AGF2-4. Con el desarrollo de la fotografía digital en la década de 1980, la técnica alcanzó su punto álgido y posteriormente, ya en el siglo XXI, las técnicas de fotografía de campo amplio han mejorado su alcance y calidad5. Las técnicas retinográficas de campo amplio han demostrado una mayor sensibilidad que el montaje de siete campos convencionales en la detección de lesiones periféricas en las uveítis posteriores, además de mejorar la tolerancia del paciente a la prueba6,7.
Principios
La luminiscencia es un fenómeno físico por el cual se emite luz por un mecanismo diferente al calor (incandescencia), como puede ser una reacción química. La fluorescencia es un tipo de luminiscencia que se produce en cuerpos fríos. La absorción de un fotón por un cuerpo frío condiciona la emisión de otro fotón, simulando una longitud de onda mayor. Normalmente la absorción del fotón se produce en el espectro ultravioleta, mientras que la emisión subsecuente se produce en el espectro visible. El brillo desaparece completamente si se elimina la luz excitadora. En la AGF, la fluoresceína que alcanza la retina brillará al ser excitada con luz azul, entre 465 y 490 nm, emitiendo una fluorescencia amarillo-verdosa de entre 520 y 530 nm. La captación fotográfica de dicha fluorescencia es la AGF8,9.El sistema es igual que el de un retinógrafo convencional, añadiendo dos filtros, el excitador y el de barrera, junto con un flash de suficiente intensidad para excitar las moléculas de fluoresceína. El filtro excitador convierte la luz del flash al espectro azul, capaz de estimular las moléculas de fluoresceína, que emiten una fluorescencia amarillo-verdosa. Para acentuar la fluorescencia emitida es necesario eliminar el reflejo azul antes de que alcance la película fotográfica. El filtro de barrera amarillo elimina el reflejo azul indeseado. Las imágenes fluorescentes pueden ser captadas de forma analógica o digital. La imagen digital se compone de píxeles, y a mayor número de píxeles, más resolución de la imagen, que suele ser como mínimo de 1.024 x 1.0248-12.
La fluoresceína sódica es un pigmento anaranjado cristalino e hidrocarbonado de bajo peso molecular (376 D). La solución acuosa adopta una coloración de rojo oscuro a amarillo-verde, dependiendo de su concentración. El color puede ser detectado a concentraciones tan bajas como 1:1.000.000 al ser iluminado con luz ultravioleta. La intensidad de la fluorescencia es máxima a pH 7,5, al estimularse con una luz de 485 nm, con una emisión en los 530 nm. La dosis recomendada en humanos para la AGF es de 5 ml al 10-20%, lo que corresponde a 15 mg/kg de peso, aproximadamente. El contraste se excreta por la orina, pudiendo dar falsos positivos en la glucosuria. Tras la inyección intravenosa, la piel se tiñe de amarillo durante unas 6 horas y el paciente debe evitar la exposición solar durante este tiempo, ya que la fluoresceína es fotosensibilizante y pueden sufrirse quemaduras solares con facilidad. Alrededor de un 70% a un 80% del contraste se une a la albúmina y a otras proteínas, mientras que el 20% restante permanece libre, siendo el principal causante de la fluorescencia. Tanto la forma conjugada como la libre pueden atravesar los vasos coriocapilares, pero nunca difundir a través de la vasculatura retiniana ni el epitelio pigmentario de la retina (EPR). La fluoresceína se metaboliza en el hígado y se excreta por el riñón. También se excreta con la leche materna, por lo que debe evitarse la lactancia durante las 12 a 24 horas siguientes a la prueba13.
Técnica
La AGF requiere una buena midriasis y la colaboración del paciente para poder alcanzar los campos periféricos.Tras la inyección de la fluoresceína en la cara volar del antebrazo, el contraste alcanza el ojo en 12 a 15 segundos, por lo que se recomienda realizar fotografías cada 0,5 segundos desde el inicio de la inyección hasta los 6 segundos, y posteriormente cada 4 a 10 segundos durante los primeros minutos y luego esperar 10 a 12 minutos para fotografiar las fases tardías.
Fases del angiograma e interpretación
La AGF consta de cinco fases13:- Fase coroidea (prearterial): la fluoresceína rellena los plexos coroideos, justo un segundo antes de iniciarse el relleno arteriolar de la retina. Se observa mejor en pacientes con albinismo o poca pigmentación. En las personas sanas, el llenado puede ser irregular (signo de Shimizu) u observarse una fluorescencia emborronada sin detalles.
- Fase arterial: 1 a 3 segundos después, se rellena el árbol arterial retiniano.
- Fase arteriovenosa: se produce tras el relleno completo del árbol arterial, capilar e inicio del relleno venoso. Este último es inicialmente laminar (en vía de tren), como consecuencia del aporte desde las pequeñas vénulas y de la mayor velocidad del flujo en el centro de las venas.
- Fase venosa: se produce cuando las arterias pierden la fluorescencia y el árbol venoso aparece totalmente hiperfluorescente.
- Fase de tránsito: se conoce como fase de tránsito a la fase coroidea, arterial, arteriovenosa y venosa en conjunto. Al final de esta fase persiste la hiperfluorescencia de la coroides y la esclera por impregnación a partir del contraste que escapa a través del plexo coriocapilar. Una pequeña cantidad de fluoresceína puede permanecer en el disco óptico y los vasos retinianos, sin extravasación. Cualquier estructura que permanezca hiperfluorescente en esta fase debe considerarse patológica.
- Fase de recirculación: representa el regreso al ojo de sangre que contiene fluoresceína desde la circulación general. La fluorescencia que produce es tenue, pues la sangre ya ha sufrido un primer filtrado renal. Es útil para observar la extravasación de contraste.
Reacciones adversas
La AGF es una técnica invasiva que puede producir reacciones alérgicas, shock y muerte. El paciente tiene que dar su consentimiento informado, y debe ser preguntado por alergias a otras sustancias y por su función renal y hepática. Un kit de resucitación debe estar disponible cerca del lugar donde se realiza la prueba, y hay que disponer de personal entrenado en reanimación cardiopulmonar. La combinación de fluoresceína con betabloqueantes puede, raramente, producir reacciones anafilácticas graves, por lo que es recomendable no tomar la dosis de betabloqueante el día de la AGF. En caso de producirse un shock anafiláctico, estos pacientes pueden ser refractarios a la adrenalina y a los expansores del plasma.La AGF está contraindicada durante el primer trimestre del embarazo, aunque no se ha demostrado teratogenicidad. Debe realizarse con cuidado en pacientes con insuficiencia renal o hepática, insuficiencia cardíaca congestiva o infarto de miocardio reciente.
En pacientes con sospecha de alergia a la fluoresceína debe realizarse un test de provocación antes de la AGF. Se inyectan 0,1 ml de fluoresceína al 20% diluida en 2 ml de solución salina y se monitoriza al paciente durante 5 minutos. Si aparece algún signo de toxicidad, la prueba no debe realizarse.
La reacción adversa más frecuente son las náuseas, que aparecen en un 3% a un 5% de los pacientes y generalmente no requieren tratamiento. Los vómitos, el prurito y los estornudos son otras posibles reacciones leves que no suelen requerir tratamiento. Las reacciones moderadas que pueden precisar una intervención médica incluyen urticaria, síncope, exantema, tromboflebitis, fiebre, necrosis local y parálisis nerviosa regional. En conjunto, pueden aparecer en uno de cada 63 casos.
En raras ocasiones se han descrito reacciones adversas graves, respiratorias (edema de glotis, broncoespasmo y anafilaxia), cardíacas (shock cardiogénico, infarto de miocardio y paro cardíaco) o neurológicas (crisis convulsivas). En conjunto no suponen más de un caso por cada 1.900 angiografías. La muerte como consecuencia de una AGF se ha estimado en 1:222.000 casos9.
Angiografía fluoresceínica en las uveítis posteriores
La AGF es una herramienta importante en el manejo de las uveítis posteriores y puede ser clave para su clasificación. Puede permitir, además, evaluar la actividad inflamatoria de las lesiones corioretinianas, la afectación de los vasos retinianos, las complicaciones maculares y la inflamación del disco óptico. No es posible estudiar las estructuras profundas, por debajo del EPR, aunque pueden descubrirse alteraciones de la coriocapilar en fases tempranas8,10-13.Retinitis
La AGF es altamente sensible para demostrar alteraciones de la barrera hematoretiniana interna, incluso a nivel capilar. Debido al pequeño tamaño de las moléculas de fluoresceína, cualquier proceso inflamatorio que produzca aumento de la permeabilidad vascular de la retina permitirá la extravasación de contraste, que se observará como un emborronamiento hiperfluorescente alrededor de los vasos, que quedarán mal delimitados. La retinitis focal o multifocal, especialmente si se asocia a desprendimiento seroso del neuroepitelio, puede ser evaluada mediante AGF con mayor precisión que con la funduscopia convencional. Así, la retinitis activa toxoplásmica o la asociada a enfermedad de Behçet se observa como focos hipofluorescentes en fases precoces que comienzan a fugar en fases arteriovenosas desde los márgenes, tornándose hiperfluorescentes en fases tardías.Vasculitis
Desde un punto de vista funcional, no obstante, la principal utilidad de la AGF en la actualidad es la evaluación de la extensión, el tipo y el grado de afectación de la vasculatura retiniana, permitiendo una aproximación al diagnóstico etiológico en algunos casos. La vasculitis retiniana puede observarse en multitud de cuadros inflamatorios posteriores, como la enfermedad de Behçet, la sarcoidosis, la coriorretinopatía en perdigonada, el lupus eritematoso sistémico, la sífilis, la tuberculosis, la toxoplasmosis, el síndrome de necrosis retiniana aguda, etc. Las uveítis intermedias también suelen presentar vasculitis periférica de bajo grado.El examen del fondo de ojo permite observar las vasculitis como focales o difusas, en función de la extensión del envainamiento vascular. Con la AGF puede observarse con mayor detalle la extensión de la inflamación de los vasos, cuyas paredes aparecen hiperfluorescentes, permitiendo la fuga del contraste a su través, que es mayor cuanto mayor es el grado de inflamación. En determinados tipos de uveítis pueden aparecer dilataciones saculares de los vasos principales (macroaneurismas), como en el síndrome de neurorretinitis, los aneurismas y la vasculitis retiniana idiopática (IRVAN), o de los capilares (microaneurismas), más propios de la retinopatía diabética, aunque visibles también en la periferia de los pacientes con coriorretinopatía en perdigonada.
En las vasculitis retinianas, la AGF permite clasificar la afectación en venosa (flebitis o periflebitis), arterial (arteritis) o capilar (capilaritis), oclusiva o no oclusiva (ver más abajo), focal o difusa, e isquemizante periférica o central (Figura 1). Así mismo, la extensión de la vasculitis puede estar limitada a uno o más cuadrantes. Muchos hallazgos angiográficos vasculares son imperceptibles en el examen del fondo de ojo, y de ahí la importancia de esta prueba en el diagnóstico y el seguimiento de todas las uveítis posteriores que pueden asociar inflamación de los vasos de la retina. La uveítis asociada a enfermedad de Behçet, en particular, debe ser evaluada periódicamente mediante AGF, pues determinados hallazgos pueden influir en las decisiones terapéuticas a tomar14-18.
En ocasiones, la fuga de contraste precoz desde los capilares retinianos puede ser tan profusa que produzca un retraso en la tinción del árbol venoso, lo que ha sido interpretado como un retraso arteriovenoso19, aunque se trata más bien de una falta de contraste que de un verdadero enlentecimiento del flujo sanguíneo. Este pseudorretraso venoso que aparece en las capilaritis profusas, con impregnación hiperfluorescente del neuroepitelio edematoso circundante, puede observarse, entre otras uveítis posteriores, en la coriorretinopatía en perdigonada y en la enfermedad de Behçet (Figura 1).

Figura 1. Coriorretinopatía en perdigonada. Transmisión de la hiperfluorescencia coriocapilar en fases precoces por atrofia central (a y b). Pseudorretraso del llenado venoso por capilaritis difusa con fuga masiva del contraste en fase venosa (c y d).
Edema macular
El EM es la causa más frecuente de pérdida visual en los pacientes con uveítis. El análisis del patrón de EM y la cuantificación del grosor, entre otros parámetros, mediante tomografía de coherencia óptica (OCT), ha desplazado notablemente a la AGF como método estándar. No obstante, la correlación entre ambas pruebas es moderada, de manera que hasta un 20% de los ojos con EM angiográfico presentan un examen tomográfico normal. Las recomendaciones actuales es examinar la mácula mediante OCT como primera opción y, en caso de no apreciar edema, puede examinarse con AGF como opción secundaria, en especial si ello puede implicar un cambio en el manejo. La falta de correlación entre la OCT y la AGF para detectar EM puede deberse a que detectan lesiones diferentes y, por tanto, son pruebas complementarias20,21.La fuga de contraste a través de los capilares maculares es una de las causas del EM. La AGF suele mostrar capilares telangiectásicos en el área parafoveal, fuga de contraste a través de los capilares anómalos y una acumulación de contraste en los espacios quísticos que suelen rodear a la fóvea, dando lugar a un patrón “petaloideo” de hiperfluorescencia. La particular anatomía de la retina neurosensorial parafoveal es, presumiblemente, la causa del patrón angiográfico en pétalos de flor del EM quístico. La ausencia de retina interna y la disposición más horizontal y radial, desde el centro de la fóvea, de las células de Müller, bipolares y excrecencias de los fotorreceptores, hacen que el exceso de fluido acumulado entre las capas nuclear interna y plexiforme externa, bien dentro de las células degeneradas de Müller o bien en los espacios extracelulares, se acumule en pequeños espacios quísticos radiales alrededor de la fóvea (Figura 2).
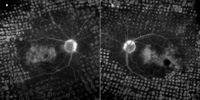
Figura 2. Síndrome de vasculitis retiniana idiopática, aneurismas y neurorretinitis (IRVAN). Extravasación difusa del contraste a nivel macular, edema macular difuso (a). Relleno de los espacios quísticos perifoveales, edema macular quístico (b). Edema macular de grado III de Miyaque y de grado IV de Yanuzzi en ambos ojos. Nótese también la hiperfluorescencia y la difuminación del escaso anillo neuroretiniano remanente a nivel superonasal de ambos ojos (papilitis).
Miyake22 describió tres grados angiográficos en el EM:
- Grado 0: no hay fuga de contraste.
- Grado I: fuga de contraste ligera en los espacios quísticos, pero que no engloba totalmente la fóvea.
- Grado II: acúmulo de fluoresceína en los espacios quísticos en los 360º alrededor de la fóvea, pero alcanzando un diámetro menor de 2 mm.
- Grado III: el acúmulo circular de fluoresceína alrededor de la fóvea es mayor o igual a 2 mm de diámetro.
- Grado 0: no hay hiperfluorescencia perifoveal.
- Grado 1: hiperfluorescencia perifoveal incompleta.
- Grado 2: hiperfluorescencia suave en los 360º.
- Grado 3: hiperfluorescencia moderada en los 360º, de 1 diámetro de disco.
- Grado 4: hiperfluorescencia intensa en los 360º, de aproximadamente 1,5 diámetros de disco.
Oclusiones vasculares
La inflamación de los vasos retinianos, tanto arteriales como venosos, puede ser suficientemente intensa como para producir fenómenos oclusivos. Las oclusiones de rama venosas o arteriales pueden producir manifestaciones clínicas o pasar inadvertidas en las fases iniciales. La AGF es de especial importancia en la confirmación del diagnóstico y para determinar el grado de extensión de la isquemia subsecuente. La oclusión de la arteria o de la vena central de la retina es excepcional en el curso de una vasculitis retiniana, aunque, de producirse, puede ponerse de manifiesto mediante la AGF.La oclusión de los capilares retinianos, no perfusión capilar o isquemia retiniana, es un fenómeno frecuente en muchas uveítis posteriores, intermedias o panuveítis. La tuberculosis, la sarcoidosis, la enfermedad de Behçet y la vasculitis retiniana idiopática son causas frecuentes de no perfusión capilar e isquemia retiniana.
La isquemia retiniana puede sospecharse clínicamente, aunque es la AGF la prueba de elección para determinar el diagnóstico y el alcance del proceso. La AGF pone de manifiesto los cortes abruptos de los vasos periféricos ocluidos, con extravasación de contraste desde los vasos telangiectásicos y shunts que aparecen justo en el borde de las áreas perfundidas. Generalmente, los vasos periféricos ocluidos aparecen hiperfluorescentes y dan paso a áreas de retina hipofluorescente debido a la ausencia de perfusión (isquemia) (Figura 3). La vasculitis isquemizante afecta normalmente a la retina periférica y puede dar lugar, si es extensa, a neovascularización de la retina14-17.

Figura 3. Vasculitis oclusiva en la fase isquémica de la enfermedad de Eales (a). Oclusión inflamatoria de las ramas venosas temporales superiores de segundo orden, efecto bloqueo de las hemorragias (hipofluorescencia) (b). Amputaciones vasculares periféricas con shunts y amplias zonas de no perfusión (hipofluorescentes) (c y d).
Cuando la falta de perfusión capilar afecta a la mácula, produce un agrandamiento y/o una irregularidad de la zona avascular de la fóvea (ZAF). En estos casos, la AGF es absolutamente esencial para establecer el diagnóstico de isquemia macular, mostrando una hipofluorescencia marcada alrededor de la fóvea, de mayor extensión y más irregular que la ZAF fisiológica. En estos casos el paciente aquejará pérdida de agudeza visual con un mal pronóstico a pesar de instaurar los tratamientos apropiados. La isquemia macular es especialmente típica en algunos casos de enfermedad de Behçet14,15.
La AGF permite también la monitorización de la respuesta terapéutica, de manera que, tras suprimir la inflamación vascular de la retina, la fuga de contraste desde los vasos y la hiperfluorescencia vascular pueden remitir o cesar. Los fenómenos oclusivos, por el contrario, raramente revierten y suelen requerir fotocoagulación con láser de las zonas isquémicas16.
Neovascularización retiniana
La neovascularización de la retina o del disco óptico se produce en alrededor de un 10% a un 15% de los pacientes con vasculitis retiniana. Los neovasos pueden observarse mediante funduscopia o AGF, aunque esta última es mucho más sensible para detectar neovasos imperceptibles clínicamente.Los neovasos aparecen hiperfluorescentes y bien perfilados en la fase arteriovenosa del angiograma, formando típicos abanicos o redes en la retina periférica o penachos a nivel de la papila. En las fases tardías, los neovasos permanecen hiperfluorescentes, aunque más difuminados como consecuencia de la fuga de contraste que se produce a su través8.
La neovascularización de la retina suele asociarse a isquemia retiniana en la AGF, ya que es un fenómeno promovido por la liberación de factores proangiogénicos desde la retina isquémica. La fotocoagulación con láser de la retina isquémica y el tratamiento intravítreo con anti-VEGF pueden ser eficaces en la regresión de la neovascularización. Por el contrario, algunas formas de vasculitis retinianas desarrollan neovascularización sin presencia evidente de isquemia retiniana ni oclusiones vasculares visibles en la AGF. Típicamente suele localizarse a nivel de la papila óptica o cerca de ella, y se especula que pueda desarrollarse como consecuencia de los factores proangiogénicos liberados por las células inflamatorias. La supresión de la inflamación, en estos casos, puede ser suficiente para la involución y la fibrosis de los neovasos10-12.
La neovascularización retiniana en las uveítis posteriores requiere tratamiento inmediato, ya que, de lo contrario, producirá hemovítreo y/o desprendimiento traccional de retina con mucha probabilidad16.
Nervio óptico
La inflamación de la cabeza del nervio óptico o papilitis es la manifestación más frecuente en las uveítis intermedias y posteriores sobre el nervio óptico. Se caracteriza por congestión vascular e hiperemia, ausencia de excavación y borramiento de los márgenes del nervio. La AGF pone de manifiesto la extravasación de contraste desde la papila, con tinción hiperfluorescente de esta en las fases tardías. Normalmente los márgenes del disco aparecerán difuminados debido a la extravasación de la fluoresceína.La AGF es útil para poner de manifiesto papilitis subclínicas, mostrando hiperfluorescencia del disco desde fases arteriovenosas. El tratamiento antiinflamatorio adecuado puede revertir esta situación, de manera que la AGF es de gran ayuda en estos casos para monitorizar la respuesta terapéutica.
Otras formas de afectación del nervio óptico en las uveítis son la neurorretinitis (bartonelosis, sífilis), la infiltración del nervio óptico (sarcoidosis), la neuropatía óptica isquémica anterior (Behçet), el papiledema (sarcoidosis) y la papiloflebitis. La AGF puede ser una herramienta importante en el diagnóstico de cualquiera de estas afecciones cuando se presentan en forma de neurorretinitis10-13.
Epitelio pigmentario de la retina
En condiciones fisiológicas, el EPR es una monocapa celular con uniones intercelulares estrechas que impiden el paso de proteínas y de la fluoresceína desde la coriocapilar hacia el espacio virtual subretiniano (barrera hematoretiniana externa). Además, el EPR contiene melanosomas capaces de filtrar parcialmente la fluorescencia proveniente de la coroides. Por tanto, la AGF es la prueba de elección en el estudio de las alteraciones del EPR que pueden aparecer en las uveítis.El descenso de pigmento en el EPR, si se acompaña de una coriocapilar preservada, produce un aumento de la fluorescencia precoz por efecto ventana, debido a un aumento en el espectro azul excitador proveniente de la coroides. Por el contrario, un aumento de la pigmentación o de cualquier otro material en el EPR o cerca de él (sangre, fibrosis) producirá una hipofluorescencia de la coroides por efecto bloqueo.
Las lesiones inflamatorias corioretinianas inactivas aparecen en la AGF como zonas bien delimitadas, hipopigmentadas o hiperpigmentadas por atrofia o hiperplasia del EPR. Las lesiones hiperpigmentadas se traducen en áreas hipofluorescentes por efecto bloqueo, mientras que las zonas atróficas se muestran como hiperfluorescentes en las fases precoces si la coriocapilar está preservada, por efecto ventana. En caso de atrofia de la coriocapilar, las lesiones aparecen hipofluorescentes, dejando ver los grandes vasos coroideos rellenos de contraste en las fases precoces, mientras que en las fases tardías las mismas zonas aparecerán hiperfluorescentes por transmisión de la tinción de la esclera con fluoresceína. La tinción de la esclera con la fluoresceína se explica por su impregnación en las fases tardías a partir de micromoléculas de contraste liberadas desde la coriocapilar preservada12,13.
La AGF permite un análisis óptimo de la localización y de la extensión del desprendimiento seroso de la retina, que se produce sobre todo en la fase aguda de la enfermedad de Vogt-Koyanagi-Harada (VKH). Se caracteriza por la aparición de múltiples puntos hiperfluorescentes en el EPR en las fases iniciales, correspondientes a puntos de fuga desde la coriocapilar hacia el espacio subretiniano. En las fases intermedias se produce el escape de contraste hacia el espacio subretiniano desprendido, y en las fases tardías su acúmulo hasta rellenarlo por completo (pooling), apareciendo hiperfluorescente. Este mismo fenómeno puede observarse en otros procesos inflamatorios, como en la oftalmía simpática y la escleritis posterior. En la fase de convalecencia del VKH, la desaparición del fluido subretiniano deja tras de sí un daño indeleble del EPR, con zonas atróficas e hiperplásicas, que producen acúmulos de pigmento. Estas zonas son fácilmente identificables mediante AGF por un patrón en “sal y pimienta” de las áreas previamente desprendidas, bien demarcadas (“marcas de agua alta”)24,25 (Figura 4).
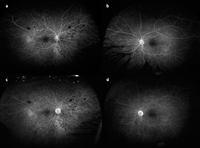
Figura 4. Fase de convalecencia en la enfermedad de Vogt-Koyanagi-Harada. La atrofia-hiperplasia del epitelio pigmentario de la retina en las zonas previamente desprendidas produce el típico patrón en “sal y pimienta” (a y b). Hiperfluorescencia con fuga tardía del disco de ambos ojos, que indica cierta actividad inflamatoria remanente tras haber recibido tres megadosis de metilprednisolona durante la fase aguda (c y d).
Coroides
Aunque la prueba ideal para el estudio de la coroides es la angiografía con verde de indocianina, la AGF puede aportar información útil sobre el estado de la coriocapilar durante el primer minuto del angiograma. Pueden observarse zonas hipofluorescentes precoces en la coriocapilar, lo que indica un retraso en la perfusión o un verdadero infarto coroideo. Estos fenómenos aparecen en varios procesos uveíticos, especialmente en el VKH, la coroidopatía serpiginosa, la epiteliopatía placoide multifocal posterior aguda (EPMPA) y el síndrome de múltiples puntos blancos evanescentes (SMPBE)8-10,24-29.En la coroidopatía serpiginosa, los bordes activos de inflamación se presentan como hipofluorescentes en las fases precoces, volviéndose hiperfluorescentes en las fases tardías, con fuga de contraste moderada al final30,31.
Otros tipos de uveítis que comparten mecanismos fisiopatogénicos (coriocapilaritis) son la EPMPA, el SMPBE y la coroiditis multifocal. En estos procesos, las lesiones activas aparecen igualmente hipofluorescentes en las fases precoces e hiperfluorescentes en las fases tardías, con ligera difusión del contraste. En el diagnóstico diferencial de estos procesos hay que considerar las coroiditis tuberculosas y luéticas, que pueden producir alteraciones muy similares de la perfusión coriocapilar. Algunas formas extensas de toxoplasmosis también pueden ocasionar coriocapilaritis con hipoperfusión durante la fase activa. La AGF también es útil para monitorizar la respuesta al tratamiento en todas estas situaciones27-29.
A diferencia de la angiografía con verde de indocianina, la AGF no permite diferenciar la isquemia del infarto a nivel de la coriocapilar, debido al efecto pantalla que se produce tras el primer minuto del angiograma. Tampoco puede detectar alteraciones profundas de la coroides, debido a la hiperfluorescencia suprayacente desde las fases precoces, por escape fisiológico del contraste desde la coriocapilar.
Otro fenómeno coroideo que puede darse en algunas formas de uveítis son los pliegues que, en el examen funduscópico, aparecen como líneas alternantes oscuras y amarillentas en el polo posterior. Típicamente se observan en el VKH y en las escleritis posteriores, y pueden ser horizontales, verticales u oblicuos. En la AGF se observan como líneas alternantes hipofluorescentes e hiperfluorescentes, correspondiendo a los valles y las crestas de los pliegues, respectivamente. La AGF puede poner de manifiesto pliegues subclínicos y diferenciarlos de los pliegues de la retina, que no interfieren en la fluorescencia basal de la coriocapilar24-26.
Las membranas neovasculares de la coroides (MNVC) pueden suceder a cualquier proceso que altere la arquitectura normal del EPR y la membrana de Bruch. Numerosas formas de uveítis posterior pueden dar lugar a MNVC, como la coroidopatía punteada interna, el síndrome de presunta histoplasmosis ocular, la coroiditis multifocal, la coroiditis serpiginosa, el VKH, la toxoplasmosis, la sarcoidosis, la tuberculosis, etc. Las MNVC pueden ser de dos tipos angiográficos, según la clasificación para la degeneración macular asociada a la edad: clásicas u ocultas. En las formas clásicas, los neovasos se rellenan precozmente de contraste, apareciendo bien definidos e hiperfluorescentes desde las fases precoces del angiograma, y manteniéndose hiperfluorescentes y exudando contraste progresivamente. En las formas ocultas, por el contrario, la hiperfluorescencia es menor y la lesión aparece poco definida. La diferenciación angiográfica de cicatrices maculares y MNVC es muy importante. Las cicatrices maculares se muestran hiperfluorescentes inicialmente en la periferia, extendiéndose hacia el centro de la lesión, sin fuga de contraste (“tinción sin fuga”). En las MNVC la tinción se inicia en los neovasos, para extenderse posteriormente hacia la periferia y emborronarse en las fases tardías por la fuga del contraste desde la red neovascular8-10.
Debilidades de la angiografía fluoresceínica en las uveítis posteriores
- Poca dilatación pupilar: la presencia de sinequias posteriores en las uveítis puede determinar una mala calidad de la exploración. Este problema se ha minimizado relativamente gracias a los sistemas de campo amplio.
- Opacidad de medios: la catarata inflamatoria o cortisólica, la vitreítis o las opacidades vítreas persistentes, y la opacificación capsular o protésica en pseudofáquicos, pueden limitar sustancialmente la calidad del angiograma, al punto de ser imposible.
- La AGF tiene un papel limitado en la exploración de la afectación coroidea.
- La alergia a la fluoresceína y la insuficiencia renal pueden contraindicar la exploración angiográfica en estos pacientes.
- La insuficiencia cardíaca y la arteriosclerosis pueden limitar o enlentecer el paso de fluoresceína hacia el ojo, produciendo una concentración insuficiente y una baja calidad del angiograma.
- La AGF requiere la canulación de una vena periférica. Por tanto, esta maniobra puede ser un factor limitante en los niños y en las personas obesas.
Angiografía fluoresceínica en las uveítis posteriores más relevantes
Enfermedad de Behçet
Dado que la vasculitis es uno de los signos más frecuentes en esta enfermedad, la AGF ha demostrado ser una de las pruebas más útiles para la valoración y la monitorización de las uveítis posteriores asociadas a enfermedad de Behçet. La fuga de contraste desde el disco óptico y los capilares retinianos se ha podido observar en pacientes con enfermedad de Behçet sin signos aparentes de uveítis.La AGF permite demostrar el engrosamiento y la tortuosidad de las venas, hiperfluorescencia de las paredes vasculares, especialmente de las venas, fuga de contraste en grandes y pequeños vasos, así como en la red capilar, tanto a nivel de la papila como de la periferia o del fondo. La persistencia de fuga en la red capilar tras un episodio agudo se ha interpretado como una respuesta inadecuada al tratamiento y se ha asociado al desarrollo de envainamiento vascular y retinitis (Figura 5).

Figura 5. Enfermedad de Behçet aparentemente en remisión con tratamiento inmunosupresor (a). Capilaritis difusa con fuga masiva del contraste e impregnación del neuroepitelio. Falso retraso de la transición arteriovenosa, hipofluorescencia en la fase venosa. Este fenómeno puede indicar falta de respuesta al tratamiento (b).
La AGF es también muy importante para detectar las oclusiones vasculares que pueden tener lugar en esta enfermedad, y la isquemia periférica que puede pasar inadvertida ópticamente (Figura 6). Por otra parte, los shunts retinocoroideos o arteriovenosos que pueden ocurrir son fácilmente distinguibles de la neovascularización mediante la AGF, indicando fotocoagulación de las zonas isquémicas en el segundo caso. Las complicaciones maculares, como el EM, la isquemia o la cicatrización, también pueden ponerse de manifiesto con la AGF14,15,18 (Figura 7).

Figura 6. Vasculitis oclusiva en la enfermedad de Behçet. La hiperfluorescencia y la difuminación de los vasos indica inflamación de las paredes vasculares. Las áreas extensas hipofluorescentes periféricas son zonas no perfundidas por oclusión vascular (isquemia).

Figura 7. Infarto macular en la enfermedad de Behçet. Asociado a un foco de retinitis próximo a la arcada temporal inferior (a), aparece irregularidad y aumento de la zona avascular de la fóvea, hiperfluorescencia y fuga de las ramas maculares de segundo orden, y ausencia de red capilar perifoveal (b).
Sarcoidosis
Cuando la sarcoidosis afecta al polo posterior, la AGF resulta especialmente útil para apoyar el diagnóstico de sospecha. Generalmente existe flebitis, que puede ser de más extensión que la observada clínicamente, aunque casi siempre de predominio segmentario en las grandes venas (Figura 8). También puede demostrarse la presencia de isquemia periférica, capilaritis o papilitis. El EM es muy frecuente, pero no así la neovascularización, que puede observarse tanto asociada a la isquemia como a la propia inflamación crónica sin isquemia. Un signo bastante específico, aunque poco frecuente, es la presencia de macroaneurismas, que suelen verse en mujeres mayores asociados a coriorretinitis multifocal periférica. Los focos corioretinianos se manifiestan en la AGF como múltiples zonas redondeadas hipofluorescentes o hiperfluorescentes por efecto ventana o bloqueo de la fluorescencia, generalmente periféricos (sarcospots)32.

Figura 8. Flebitis segmentaria en la sarcoidosis ocular posterior (a). La angiografía fluoresceínica en fase de transición muestra una suboclusión de la parte distal de la arcada venosa temporal superior (b). En fases tardías se observa fuga de contraste desde los segmentos venosos inflamados (c).
Síndromes de manchas blancas
Este grupo de enfermedades afectan primariamente a la coriocapilar y secundariamente pueden extenderse al EPR y la retina.En el SMPBE, la AGF puede mostrar zonas hipofluorescentes a nivel de la coriocapilar en fases muy precoces, que se tiñen a lo largo del angiograma hasta volverse hiperfluorescentes (tinción tardía). No obstante, el valor de la AGF puede ser limitado en el SMPBE, dado que algunas formas no aparecen en el angiograma o son muy tenues, mientras otras son claramente visibles. También puede observarse hiperfluorescencia y fuga en el disco óptico de algunos SMPBE.
En la fase aguda de la EPMPA, la AGF muestra múltiples zonas de hipofluorescencia precoz a nivel coriocapilar, con tinción tardía hasta la hiperfluorescencia, fuga de contraste y acúmulo (pooling).
Estas zonas corresponden a múltiples focos de isquemia coroidea, con retraso de la perfusión. La isquemia coriocapilar afecta a la retina externa y secundariamente a la interna, que es la causante de la hiperfluorescencia tardía de estas lesiones. En la fase de convalecencia pueden observarse zonas parcheadas de hipofluorescencia e hiperfluorescencia correspondientes a los efectos de bloqueo y ventana producidos por la cicatrización del EPR (atrofia/hiperplasia)33.
En la coroiditis multifocal y en la coroiditis punteada interna, la AGF suele demostrar múltiples focos, pequeños a medianos, hiperfluorescentes e hipofluorescentes que se localizan preferentemente alrededor de la papila y en el fondo. Se trata de focos cicatriciales antiguos que dejan ver la fluorescencia escleral, en casos de atrofia, o que producen bloqueo y enmascaran la fluorescencia cuando hay hiperplasia o aglutinación del EPR. Los signos que indican lesiones recientes y activas son, como en los casos anteriores, la hipofluorescencia precoz con tinción tardía y fuga. En un mismo ojo suelen coincidir lesiones antiguas y recientes (Figura 9). No obstante, la AGF no es una buena técnica para monitorizar la actividad en la coroiditis multifocal, puesto que muchas lesiones activas pueden ser muy sutiles o imperceptibles. Es relativamente frecuente la neovascularización coroidea a partir de los focos cicatriciales, y en estos casos la AGF demostrará con facilidad la hiperfluorescencia y la fuga de las membranas activas27-29.
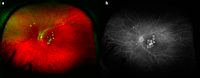
Figura 9. Coroiditis punteada interna (a). La angiografía muestra lesiones cicatriciales con hiperfluorescencia en anillo en la zona macular, con fibrosis central correspondiente a una membrana neovascular antigua. En el sector nasal se observan lesiones activas, con hiperfluorescencia central y fuga en las fases tardías (b).
Coroiditis serpiginosa, ampiginosa y pseudoserpiginosa
La distinción de estas afecciones, similares entre sí, aunque no es angiográfica puede verse reforzada por los hallazgos en la AGF. Las formas pseudoserpiginosas se asocian a enfermedades infecciosas, en especial a la tuberculosis, por lo que requieren un manejo radicalmente distinto de las formas clásicas34.Las placas ameboides de afectación corioretiniana progresan centrífugamente. Las lesiones activas aparecen en el angiograma como hipofluorescentes en las fases precoces, con tinción hiperfluorescente y fuga discreta en las fases más tardías. Las zonas inactivas se observan como hipofluorescentes en las fases precoces, dejando entrever los grandes vasos coroideos por atrofia de la coriocapilar. En las fases tardías, las lesiones inactivas se tornan hiperfluorescentes, con mayor intensidad en los bordes, que aparecen bien delimitados por la ausencia de fuga30,31,35 (Figura 10, Figura 11, Figura 12).

Figura 10. Coroiditis serpiginosa clásica (a). La angiografía muestra una zona activa hipofluorescente en fase arterial e hiperfluorescente en fase tardía, próxima a la mácula. Por el contrario, las zonas inactivas solo captan contraste en los bordes (b).

Figura 11. Coroiditis serpiginosa clásica (a y b). En las formas más evolucionadas, las zonas de actividad no son tan aparentes, apareciendo como bordes difusos hiperfluorescentes en fases tardías (c y d) (flechas blancas).

Figura 12. Coroiditis pseudoserpiginosa asociada a tuberculosis (a y b). Las lesiones inactivas son hiperfluorescentes e hipofluorescentes de forma abigarrada por los cambios en el epitelio pigmentario (efectos ventana y bloqueo) (c). Las lesiones activas aparecen hipofluorescentes en las fases precoces (d) y se vuelven progresivamente hiperfluorescentes y difuminadas en las fases más tardías (e y f).
Mientras que en las formas pseudoserpiginosas las lesiones suelen respetar el área peripapilar, ser multifocales y extenderse hacia la periferia, en las serpiginosas la lesión tiende a ser única o presentar pocos focos y se inicia junto al disco óptico. En las fases tempranas, la forma clásica no suele comprometer la periferia, excepto en la coroiditis ampiginosa, que se ha descrito como de inicio y predominio periférico. Esporádicamente se han comunicado flebitis y neovascularización coroidea asociadas30,34.
Enfermedad de Vogt-Koyanagi-Harada y oftalmía simpática
Durante la fase aguda de la enfermedad, y ocasionalmente durante las recurrencias, la AGF muestra múltiples puntos hiperfluorescentes precoces en el EPR, correspondientes a los puntos de fuga hacia el espacio subretiniano. En las fases tardías se produce un acúmulo de fluoresceína en los espacios subretinianos (pooling) hasta ocupar totalmente los desprendimientos serosos, que aparecen hiperfluorescentes. Típicamente la papila aparece también hiperfluorescente y con fuga de contraste en las fases tardías del angiograma (Figura 13).

Figura 13. Enfermedad de Vogt-Koyanagi-Harada aguda. En las fases prearterial y arterial son visibles manchas hipofluorescentes en la coriocapilar, correspondientes a focos coroideos inflamatorios (a). En las fases intermedias se observan múltiples puntos hiperfluorescentes correspondientes a los defectos del epitelio pigmentario por donde se fuga el contraste (b y c). En las fases tardías el contraste se acumula en todos los espacios subretinianos con desprendimiento seroso (pooling) (c).
En la fase crónica, la AGF muestra un patrón abigarrado hiper-hipofluorescente del EPR por bloqueo y efecto ventana en las zonas previamente desprendidas, que aparecen bien delimitadas (“marcas de agua alta”) (Figura 4). Durante la fase crónica, la hiperfluorescencia del disco óptico puede ser el único signo angiográfico que indique actividad inflamatoria. En algunos ojos puede observarse neovascularización coroidea o fibrosis subretiniana como complicación tardía24-26.
La oftalmía simpática puede mostrar hallazgos idénticos a los del VKH, aunque con mayor tendencia a la cronicidad y a la aparición de complicaciones tardías, especialmente fibrosis subretiniana.
Corioretinopatía en perdigonada (birdshot chorioretinopathy)
En la enfermedad temprana activa, la AGF muestra vasculitis difusa, especialmente flebitis, con hiperfluorescencia y fuga de contraste de los vasos de mayor calibre (Figura 14). También es característica la capilaritis, que aparece en el angiograma como un patrón moteado hiperfluorescente que se extiende por el fondo y la periferia. En ocasiones la fuga capilar es tan grande que produce impregnación difusa del neuroepitelio, que aparece hiperfluorescente. Debido a la fuga de contraste en las arteriolas y los capilares en los tiempos precoces, puede aparecer un falso retraso en la tinción del árbol venoso (aunque la perfusión no esté retardada)19 (Figura 15).

Figura 14. Coriorretinopatía en perdigonada de inicio reciente. En la fase prearterial pueden verse zonas hipofluorescentes de inflamación coriocapilar (a). Progresivamente se instaura hiperfluorescencia y fuga del disco (“discos calientes”), y fuga del contraste en los vasos principales (vasculitis difusa) (b, c y d).

Figura 15. Algunas formas de coriorretinopatía en perdigonada se acompañan de intensa capilaritis (a y b).
A pesar de observar una alteración angiográfica profusa en muchos casos de coriorretinopatía en perdigonada, esto no supone una indicación absoluta de tratamiento inmunomodulador, pues muchos de estos ojos permanecerán con agudeza visual y campimetría estables durante muchos años, sin necesidad de tratamientos agresivos. Es característica también de la fase activa precoz una papilitis importante que se traduce en tinción hiperfluorescente del disco óptico y difuminación por fuga en las fases tardías. Así mismo, el EM es un hallazgo frecuente que aparece en el angiograma con el clásico patrón petaloideo o en crisantemo hiperfluorescente en las fases tardías.
En los casos de coriorretinopatía en perdigonada de larga evolución o enfermedad “quemada”, los hallazgos angiográficos característicos son las manchas hipofluorescentes precoces que se hacen hiperfluorescentes abigarradas en las fases tardías, y que aparecen por efecto ventana en las zonas de atrofia corioretiniana. Los vasos retinianos se ven finos y angulados, y pueden observarse alteraciones crónicas del EPR como consecuencia de la inflamación crónica36,37 (Figura 16).

Figura 16. Coriorretinopatía en perdigonada inactiva. En las fases precoces se observan focos fusiformes hipofluorescentes de distribución centrífuga desde la papila, correspondientes a lesiones inflamatorias coroideas (a y b). Las fases tardías del angiograma revelan atrofia macular, con transmisión de la hiperfluorescencia coriocapilar en el ojo derecho (c). Las lesiones coriocapilares se vuelven tenuemente isofluorescentes por atrofia de la retina suprayacente (c y d). La angiografía de campo amplio permite ver signos de isquemia crónica periférica (c y d).
Retinitis toxoplásmica
La retinitis focal toxoplásmica típica aparece en el angiograma como un foco hipofluorescente en las fases precoces. Seguidamente se observa extravasación progresiva del contraste desde los vasos circundantes y los bordes de la lesión activa, hasta convertirse en un foco hiperfluorescente difuso en las fases tardías.No obstante, la AGF resulta más reveladora en los casos atípicos: formas de neurorretinitis, con focos yuxtapapilares, hiperfluorescencia y fuga desde el disco; formas multifocales, punteadas externas (Figura 17), y formas vasculíticas, que suelen ser segmentarias y oclusivas en algunas ocasiones. Otras complicaciones, como el EM, el desprendimiento seroso o la neovascularización coroidea sobre las cicatrices antiguas, son también posibles en estas uveítis posteriores. La AGF es de gran utilidad para desvelar los hallazgos de las formas atípicas o complicadas.

Figura 17. Toxoplasmosis ocular, forma punteada externa. La imagen retinográfica apenas revela pequeños focos amarillentos maculares (a). La angiografía fluoresceínica permite discernir perfectamente las lesiones en esta forma atípica (b).
Sífilis
La sífilis puede afectar al polo posterior y adoptar múltiples formas clínicas. La retinitis suele ser multifocal y de pequeño tamaño, aunque a veces es extensa. Las lesiones retinianas activas se observan como focos hipofluorescentes que se tornan hiperfluorescentes en las fases tardías. Es frecuente la asociación de vasculitis, neurorretinitis y coroiditis. Las áreas de retinitis dejan zonas de atrofia moteada con aglutinación e hiperplasia del EPR, que se observan en el angiograma como un patrón moteado hipofluorescente por bloqueo (espiculado) o en “manchas de leopardo”. Este patrón es bastante específico de la retinitis luética, aunque no patognomónico38. La papila suele aparecer hiperfluorescente y con fuga de contraste por la neuritis asociada (Figura 18 y Figura 19).

Figura 18. Retinitis luética con amplia afectación periférica, donde el epitelio pigmentario aparece hiperplásico y aglutinado (clumping), formando espículas que bloquean la fluorescencia (a y b). La hiperfluorescencia y la fuga de la papila indican inflamación del nervio óptico (c y d).

Figura 19. Retinitis luética (a). La angiografía revela las alteraciones del epitelio pigmentario dando el patrón típico de “manchas de leopardo” (b).
Retinitis herpéticas
Dentro de las retinitis herpéticas, las formas necrotizantes son, probablemente, las más frecuentes, siendo la más típica el síndrome de necrosis retiniana aguda. La AGF es de gran utilidad en estos casos para definir la extensión del cuadro, valorar complicaciones y en ocasiones orientar el diagnóstico. El principal problema es la vitreítis que suele acompañar al síndrome de necrosis retiniana aguda, la cual puede ser muy limitante para la calidad del angiograma.Las extensas áreas de necrosis retiniana focal son, por lo general, periféricas y se acompañan de una intensa vasculitis oclusiva de predominio arteriolar. La AGF muestra hipofluorescencia de las zonas necróticas por ausencia de perfusión, amputación vascular, oclusión capilar e hiperfluorescencia del disco. El EM es frecuente y se observa como fuga hiperfluorescente en las fases tardías, junto con la fuga de contraste desde la papila y la impregnación difusa del neuroepitelio isquémico en las zonas limítrofes a la necrosis establecida (Figura 20).

Figura 20. Síndrome de necrosis retiniana aguda por vírus herpes simple tipo 1. El desprendimiento de retina requirió cirugía precoz con reaplicación, indentación con banda de silicona y endoláser (a). La angiografía fluoresceínica muestra la expansión de la retina necrótica, fuga de contraste desde el disco óptico e impregnación del neuroepitelio con edema macular.
Tuberculosis
La uveítis posterior asociada a la tuberculosis adopta diversas formas. El granuloma coroideo aparecerá hipofluorescente en las fases muy precoces, e isofluorescente o hiperfluorescente en las fases más tardías del angiograma, tanto más intenso cuanta mayor sea la afectación del EPR y de la retina suprayacente, en especial si existe fluido subretiniano asociado (Figura 21 y Figura 22). En algunos casos puede observarse una anastomosis retinocoroidea en el centro del granuloma35.

Figura 21. Tubérculo coroideo reactivado (a). Hipofluorescencia precoz (a) e hiperfluorescencia tardía con fuga y acúmulo del contraste, produciendo edema macular (b y c).

Figura 22. Pérdida del reflejo foveolar en el ojo derecho de un paciente con tuberculosis miliar (a y b). La angiografía fluoresceínica revela múltiples tubérculos coroideos miliares hiperfluorescentes por impregnación del neuroepitelio suprayacente en las fases tardías, y confirma el edema macular del ojo derecho (c y d).
Las vasculitis pueden ser segmentarias o difusas, oclusivas o no, y pueden afectar a la periferia o las arcadas principales. Típicamente, la vasculitis asociada a la tuberculosis muestra pequeños focos de coriorretinitis, a veces cicatrizados, adyacentes a los vasos. Las vasculitis asociadas a la tuberculosis pueden asociar neovascularización retiniana periférica con bastante frecuencia, debido a la isquemia crónica que producen y a la inflamación persistente16 (Figura 3). Otras formas, como las coroiditis pseudoserpiginosas, se han descrito más arriba34,35 (Figura 12).
Bibliografía
- Maclean AL, Maumenee AE. Hemangioma of the choroid. Am J Ophthalmol. 1960;50:3-11.
- Novotny HR, Alvis DL. A method of photographing fluorescence in circulating blood in the human retina. Circulation. 1961;24:82-6.
- Hodge JV, Clemett RS. Improved method for fluorescence angiography of the retina. Am J Ophthalmol. 1966;61(6):1400-4.
- Oosterhuis JA, Lammens AJ. Fluorescein photography of the ocular fundus. Ophthalmologica. 1965;149:210-20.
- Patel M, Kiss S. Ultra-wide-field fluorescein angiography in retinal disease. Curr Opin Ophthalmol. 2014;25(3):213-20.
- Nicholson BP, Nigam D, Miller D, Agrón E, Dalal M, Jacobs-El N, et al. Comparison of wide-field fluorescein angiography and 9-field montage angiography in uveitis. Am J Ophthalmol. 2014;157(3):673-7.
- Hong BK, Nazari Khanamiri H, Rao NA. Role of ultra-wide field fluorescein angiography in the management of uveitis. Can J Ophthalmol. 2013;48(6):489-93.
- De Laey JJ. Fluorescein angiography in posterior uveitis. Int Ophthalmol Clin. 1995;35(3):33-58.
- Yannuzzi LA, Rohrer KT, Tindel LJ, Sobel RS, Costanza MA, Shields W, et al. Fluorescein angiography complication survey. Ophthalmology. 1986;93(5):611-7.
- Ciardella AP, Prall FR, Borodoker N, Cunningham ET Jr. Imaging techniques for posterior uveitis. Curr Opin Ophthalmol. 2004;15(6):519-30.
- Finamor LP, Muccioli C, Belfort R Jr. Imaging techniques in the diagnosis and management of uveitis. Int Ophthalmol Clin. 2005;45(2):31-40.
- Gupta V, Al-Dhibi HA, Arevalo JF. Retinal imaging in uveitis. Saudi J Ophthalmol. 2014;28(2):95-103.
- Berkow JW, Kelly JS, Orth DH. Fluorescein angiography. A guide to the interpretation of fluorescein angiograms. 2nd ed. San Francisco: American Academy of Ophthalmology; 1984. p. 9-16.
- Matsuo T, Sato Y, Shiraga F, Shiragami C, Tsuchida Y. Choroidal abnormalities in Behçet disease observed by simultaneous indocyanine green and fluorescein angiography with scanning laser ophthalmoscopy. Ophthalmology. 1999;106(2):295-300.
- Kim M, Kim H, Kwon HJ, Kim SS, Koh HJ, Lee SC. Choroidal thickness in Behcet’s uveitis: an enhanced depth imaging-optical coherence tomography and its association with angiographic changes. Invest Ophthalmol Vis Sci. 2013;54(9):6033-9.
- Biswas J, Sharma T, Gopal L, Madhavan HN, Sulochana KN, Ramakrishnan S. Eales disease - an update. Surv Ophthalmol. 2002;47(3):197-214.
- Kleiner RC, Kaplan HJ, Shakin JL, Yannuzzi LA, Crosswell HH Jr, McLean WC Jr. Acute frosted retinal periphlebitis. Am J Ophthalmol. 1988;106(1):27-34.
- Mesquida M, Llorenç V, Fontenla JR, Navarro MJ, Adán A. Use of ultra-wide-field retinal imaging in the management of active Behçet retinal vasculitis. Retina. 2014. [Epub ahead of print].
- Gass JD. Vitiliginous chorioretinitis. Arch Ophthalmol. 1981;99(10):1778-87.
- Nussenblatt RB, Kaufman SC, Palestine AG, Davis MD, Ferris FL 3rd. Macular thickening and visual acuity. Measurement in patients with cystoid macular edema. Ophthalmology. 1987;94(9):1134-9.
- Kempen JH, Sugar EA, Jaffe GJ, Acharya NR, Dunn JP, Elner SG, et al. Multicenter Uveitis Steroid Treatment (MUST) Trial Research Group. Fluorescein angiography versus optical coherence tomography for diagnosis of uveitic macular edema. Ophthalmology. 2013;120(9):1852-9.
- Miyake K. Prevention of cystoid macular edema after lens extraction by topical indomethacin (I). A preliminary report. Graefes Arch Clin Exp Ophthalmol. 1977;203(2):81-8.
- Yannuzzi LA. A perspective on the treatment of aphakic cystoid macular edema. Surv Ophthalmol. 1984;28(Suppl):540-53.
- Read RW, Rao NA, Cunningham ET. Vogt-Koyanagi-Harada disease. Curr Opin Ophthalmol. 2000;11(6):437-42.
- Sakata VM, da Silva FT, Hirata CE, de Carvalho JF, Yamamoto JH. Diagnosis and classification of Vogt-Koyanagi-Harada disease. Autoimmun Rev. 2014;13(4-5):550-5.
- Sakata VM, da Silva FT, Hirata CE, Takahashi WY, Costa RA, Yamamoto JH. Choroidal bulging in patients with Vogt-Koyanagi-Harada disease in the non-acute uveitic stage. J Ophthalmic Inflamm Infect. 2014;4(1):6.
- Knecht PB, Papadia M, Herbort CP. Secondary choriocapillaritis in infectious chorioretinitis. Acta Ophthalmol. 2013;91(7):e550-5.
- Fung AT, Pal S, Yannuzzi NA, Christos P, Cooney M, Slakter JS, et al. Multifocal choroiditis without panuveitis: clinical characteristics and progression. Retina. 2014;34(1):98-107.
- Spaide RF, Goldberg N, Freund KB. Redefining multifocal choroiditis and panuveitis and punctate inner choroidopathy through multimodal imaging. Retina. 2013;33(7):1315-24.
- Lim WK, Buggage RR, Nussenblatt RB. Serpiginous choroiditis. Surv Ophthalmol. 2005;50(3):231-44.
- Nazari Khanamiri H, Rao NA. Serpiginous choroiditis and infectious multifocal serpiginoid choroiditis. Surv Ophthalmol. 2013;58(3):203-32.
- Papadia M, Herbort CP, Mochizuki M. Diagnosis of ocular sarcoidosis. Ocul Immunol Inflamm. 2010;18(6):432-41.
- Quillen DA, Davis JB, Gottlieb JL, Blodi BA, Callanan DG, Chang TS, et al. The white dot syndromes. Am J Ophthalmol. 2004;137(3):538-50.
- Nazari Khanamiri H, Rao NA. Serpiginous choroiditis and infectious multifocal serpiginoid choroiditis. Surv Ophthalmol. 2013;58(3):203-32.
- Gupta V, Gupta A, Rao NA. Intraocular tuberculosis - an update. Surv Ophthalmol. 2007;52(6):561-87.
- Monnet D, Brézin AP. Birdshot chorioretinopathy. Curr Opin Ophthalmol. 2006;17(6):545-50.
- Tomkins-Netzer O, Taylor SR, Lightman S. Long-term clinical and anatomic outcome of birdshot chorioretinopathy. JAMA Ophthalmol. 2014;132(1):57-62.
- Balaskas K, Sergentanis TN, Giulieri S, Guex-Crosier Y. Fluorescein and indocyanine-green angiography in ocular syphilis: an exploratory study. Graefes Arch Clin Exp Ophthalmol. 2012;250(5):721-30.

