Volumen 23 - Número 5 - Diciembre 2015
Protocolo diagnóstico y terapéutico del síndrome misdireccional y el glaucoma maligno
M. Garriga, M. Castany, A. Boixadera, J. Rigo, A. Dou  (Incluye vÃdeo)
Servicio de Oftalmología. Hospital Vall d’Hebron. Barcelona.
CORRESPONDENCIA
Mireia Garriga
E-mail: mireiagarrigabeguiristain@gmail.com
E-mail: mireiagarrigabeguiristain@gmail.com
RESUMEN
El síndrome misdireccional es una de las complicaciones más temidas y a la vez infrecuentes de la cirugía filtrante ocular para el glaucoma.
El cuadro presenta de forma característica un estrechamiento central y periférico de la cámara anterior del ojo, creyéndose secundario a anormalidades en la disposición del vítreo anterior, a una alteración de la permeabilidad de la hialoides anterior y a una probable expansión coroidea.
Son múltiples los factores de riesgo que predisponen a sufrirlo, entre ellos destacan la presencia de cámara anterior estrecha, el glaucoma de ángulo cerrado y la afaquia.
A continuación se presenta el protocolo diagnóstico y terapéutico utilizado para esta patología en nuestro centro de acuerdo a nuestra experiencia.
El cuadro presenta de forma característica un estrechamiento central y periférico de la cámara anterior del ojo, creyéndose secundario a anormalidades en la disposición del vítreo anterior, a una alteración de la permeabilidad de la hialoides anterior y a una probable expansión coroidea.
Son múltiples los factores de riesgo que predisponen a sufrirlo, entre ellos destacan la presencia de cámara anterior estrecha, el glaucoma de ángulo cerrado y la afaquia.
A continuación se presenta el protocolo diagnóstico y terapéutico utilizado para esta patología en nuestro centro de acuerdo a nuestra experiencia.
RESUM
La síndrome misdireccional és una de les complicacions més temudes i alhora infreqüents de la cirurgia filtrant ocular pel glaucoma.
El quadre presenta de forma característica un estretament central i perifèric de la càmara anterior de l’ull, creient-se secundari a anormalitats en la disposició del vitri anterior, a una alteració de la permeabilitat de la hialoides anterior i a una probable expansió coroidea.
Són múltiples els factors de risc que predisposen a patir-la, entre ells destaquen la presència de càmara anterior estreta, el glaucoma d’angle tancat i l’afàquia.
A continuació es presenta el protocol diagnòstic i terapèutic emprat per aquesta patologia al nostre centre d’acord amb la nostre experiència.
El quadre presenta de forma característica un estretament central i perifèric de la càmara anterior de l’ull, creient-se secundari a anormalitats en la disposició del vitri anterior, a una alteració de la permeabilitat de la hialoides anterior i a una probable expansió coroidea.
Són múltiples els factors de risc que predisposen a patir-la, entre ells destaquen la presència de càmara anterior estreta, el glaucoma d’angle tancat i l’afàquia.
A continuació es presenta el protocol diagnòstic i terapèutic emprat per aquesta patologia al nostre centre d’acord amb la nostre experiència.
ABSTRACT
The misdirection syndrome is one of the most feared and rare complications of glaucoma ocular filtring surgery.
In this pathology an anterior chamber shallowing central and peripheral is characteristic, thought to be secondary to an abnormal vitreous disposition, an alteration of the permeability in the anterior hialoid membrane and a likely choroidal expansion.
There are many predisposing risk factors, highlighting the presence of narrow anterior chamber, closed angle glaucoma and aphakia.
Then the diagnostic and therapeutic protocol for this disease in our center is presented according to our experience.
In this pathology an anterior chamber shallowing central and peripheral is characteristic, thought to be secondary to an abnormal vitreous disposition, an alteration of the permeability in the anterior hialoid membrane and a likely choroidal expansion.
There are many predisposing risk factors, highlighting the presence of narrow anterior chamber, closed angle glaucoma and aphakia.
Then the diagnostic and therapeutic protocol for this disease in our center is presented according to our experience.
Introducción
Se confiere el término de síndrome misdireccional a aquél cuadro oftalmológico caracterizado por un estrechamiento de la cámara anterior central y periférica del ojo, que se presenta pese a la presencia de una iridotomía periférica permeable, asociado en la mayoría de los casos a un aumento de la presión intraocular progresivo y de difícil control1.Los primeros casos fueron descritos en 1869 por von Graefe en pacientes con glaucoma de cierre angular agudo posteriormente a la realización de iridectomía periférica. Le confirió el apelativo de maligno dado la agresividad y el mal pronóstico visual observado2.
La nomenclatura utilizada para describir el cuadro en la literatura no es homogénea debido al desconocimiento del mecanismo fisiopatológico causal y comprende nombres como el de bloqueo ciliar o vítreo, glaucoma ciliolenticular, glaucoma por expansión vítrea o por presión vítrea positiva.
La mayoría de casos se presentan de forma unilateral, pese a que se han descrito algunos casos con un inicio bilateral simultáneo, y debe tenerse siempre en cuenta el riesgo de presentación del síndrome en el ojo contralateral si se presentan algún factor desencadenante.
Factores desencadenantes
Este cuadro puede producirse después de una cirugía filtrante en ojos afectos de glaucoma de ángulo cerrado primario (0,4-6%)3, especialmente en aquellos casos avanzados, pudiendo aparecer desde intraquirúrgicamente hasta muchos años después de la misma.También puede desencadenarse tras cirugía de facoemulsificación, sea cual sea la técnica utilitzada (intracapsular, extracapsular o facoemulsificación)4,5, tras cirugías como el implante de lentes fáquicas6, la queratoplastia penetrante7,8, la vitrectomía via pars plana9,10 o el implante de dispositivos de drenaje11,12 y después de ciertos procedimientos láser13-15 (capsulotomía, iridotomía, suturolisis de flapescleral o ciclofotocoagulación).
En la literatura se describen también casos aislados de glaucoma maligno espontáneo16,17, así como asociados a revisión de la ampolla de filtración con aguja (needling)18, queratocono en síndrome de Down19, retinopatía de la prematuridad20 y oclusión venosa retiniana21.
Factores de riesgo
Se describe una mayor incidencia del síndrome en mujeres, posiblemente en asociación a una cámara anterior más pequeña con una disposición más anterior del cristalino22.Se conoce como principal factor de riesgo la historia de síndrome misdireccional en el ojo contralateral. Otros factores de riesgo reconocidos son la hipermetropía, el glaucoma de ángulo cerrado agudo o crónico y la afaquia23. También el nanoftalmos24, la configuración en iris plateau25 y las lentes intraoculares de gran diámetro26.
Aquellas cirugías o procedimientos oftalmológicos que ocasionen una descompresión ocular brusca también serán susceptibles de producirlo, así como el inicio de tratamiento con mióticos tópicos o el cese abrupto de la administración de ciclopléjicos27,28.
La mayoría se presentan de forma unilateral, pese a que se han descrito algunos casos con un inicio bilateral simultáneo29. Cabe tener siempre en cuenta la posibilidad de aparición del síndrome en el ojo contralateral si se presentan las condiciones propicias.
Fisiopatología
Se desconoce el mecanismo fisiopatogénico exacto causante del síndrome. Las diferentes teorías barajadas a lo largo de los años proponen una relación alterada entre cuerpo ciliar, lente, hialoides anterior y vítreo, resultando en un desplazamiento anterior del diafragma íridocristaliniano.La debilidad y laxitud zonular asociada a un aumento de la presión posterior fueron propuestas inicialmente como desencadenantes del proceso30. Más recientemente Quigley describió una expansión coroidea como factor favorecedor de la rotación del cuerpo ciliar, tras empujar el vítreo y la hialoides hacia él31-33.
Para intentar entender el complejo mecanismo que se produce también cabe recordar las propiedades de impermeabilidad que adquiere la hialoides en esta situación y que actúa como una válvula unidireccional aumentando la resistencia al flujo y atrapando fluido en el vítreo anterior, que al aumentar de volumen favorecerá la anteriorización iridocristaliniana.
Durante la realización de una cirugia ocular la rotación anterior del cuerpo ciliar también puede deberse secundariamente a la presencia de adhesiones (sinequias anteriores periféricas, sinequias posteriores, adhesiones zonulo-capsulares) o al emplazamiento de gas, viscoelástico o solución salina en el vítreo anterior34-36.
Diagnóstico (Figura 1)
El primer cambio que los pacientes pueden detectar es ocasionado por la miopización que produce el avance del cristalino o la lente intraocular (mejoría en la visión cercana, empeoramiento en la lejana).No todos los pacientes presentarán una presión intraocular elevada al inicio del cuadro, condición que puede entorpecer el juicio diagnóstico, y que debe tenerse siempre en cuenta. Es por ello que un diagnóstico precoz del síndrome será esencial para evitar llegar a esta fase de glaucoma maligno.
La cámara anterior se estrechará tanto central como periféricamente, y al aumentar la presión intraocular aparecerá congestión conjuntival, dolor, inflamación y edema corneal microquístico. Si esta persiste en el tiempo podrán desarrollarse complicaciones tales como la neuropatía glaucomatosa, la descompensación corneal crónica, las sinequias anteriores o posteriores y las cataratas.
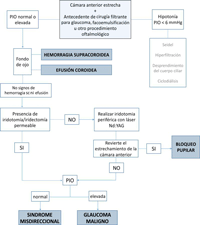
Figura 1. Algoritmo para el diagnóstico diferencial del síndrome misdireccional y el glaucoma maligno.
Diagnóstico diferencial
El diagnóstico diferencial debe establecerse principalmente con el glaucoma agudo por bloqueo pupilar, descartándolo con la presencia de una iridotomía/iridectomía periférica permeable o realizándose en caso de no existir.Resultará imprescindible buscar cualquier masa en iris, cuerpo ciliar o retina (hemorragia supracoroidea) suficientemente grande como para desplazar anteriormente el cuerpo ciliar. Si la exploración funduscópica no es posible por opacidad de medios se realizará una ecografía B.
La biomicroscopía ultrasónica (UBM) se ha mostrado superior a la tomografía de coherencia óptica (OCT) en la visualización del cuerpo ciliar y la cámara posterior, ayudando a visualizar la rotación del mismo y facilitando el diagnóstico diferencial37.
Tratamiento (Figura 2)
El objetivo del tratamiento de todo tratamiento a realizar será reestablecer la difusión normal del humor acuoso para que el cuerpo ciliar pueda retroceder y recuperar la posición normal del diafragma irido-cristaliniano. Se romperá de esta manera el círculo vicioso establecido y se reducirá la presión intraocular al recobrar una malla trabecular funcionante. No existe en la literatura un gold estandard establecido, proponiéndose un protocolo escalonado hasta conseguir la resolución del cuadro de forma estable.
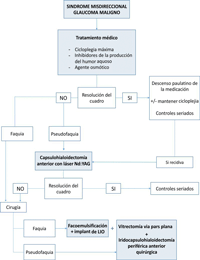
Figura 2. Algoritmo terapéutico del síndrome misdireccional y el glaucoma maligno.
Tratamiento médico
El tratamiento médico resultará la primera opción terapéutica a tomar, siendo la menos invasiva y con menores efectos adversos. Se asocian los siguientes colirios:- Ciclopléjicos tópicos (Atropina, ciclopentolato) para acortar las fibras zonulares y posteriorizar el diafragma iridocristaliniano.
- Agentes hiperosmóticos (manitol endovenoso) para reducir el volumen vítreo.
- Inhibidores de la anhidrasa carbónica tópicos y orales, betabloqueantes tópicos y alfa agonistas tópicos para recudir la producción de humor acuoso.
- Puede valorarse el uso de corticoides tópicos para reducir la inflamación presente.
Si el tratamiento resulta efectivo se objetivará una restitución progresiva en la profundidad de la cámara anterior y posteriormente un control de la presión intraocular.
Se describen en la literatura resultados variables en cuanto a resolución sólo con tratamiento médico (8%-50%), siendo habitualmente mejores en pacientes fáquicos38,39. Existe también un alto riesgo de recidiva durante el cese del mismo, planteándose en ciertos casos el mantenimiento crónico de cicloplejia tópica para evitarlo. El resto de medicación deberá ser reducida paulatinamente, en primer lugar retirando el manitol endovenoso y posteriormente reduciendo los supresores del humor acuoso.
Tratamiento láser
En aquellos pacientes pseudofáquicos o afáquicos en los que el tratamiento médico resulte ineficaz se optará por el láser Nd: YAG como segundo escalón terapéutico.Se debe realizar una capsulohialoidectomia periférica a través de una iridotomía periférica permeable, buscando abrir un nuevo camino al flujo de humor acuoso, permitiendo una descompresión del vítreo y un equilibrio entre las presiones de cámara anterior y posterior40,41.
En caso de resultar exitoso la mejoría será inmediata, ampliándose progresivamente la cámara anterior durante los siguientes días al procedimiento láser.
Se describe entre un 15 a un 40% de no respuesta en las cortas series publicadas42,43, debiendo tener en cuenta la posibilidad de recidiva tras el procedimiento y la herniación vítrea secundaria al mismo
Tratamiento quirúrgico
Resultará de primera elección la opción quirúrgica en menos de 24 horas si se presenta una atalamia grado 3, para prevenir la formación de sinequias, catarata y daño endotelial irreversible44.En aquellos pacientes fáquicos y en los que el láser Nd:YAG no sea capaz de revertir el cuadro se procederá también a indicar la cirugía.
Esta consistirá en realizar una vitrectomía via para plana transconjuntival (23 o 25G) asociando una irido-capsulohialoidectomía periférica que permita comunicar la cavidad vítrea con la cámara posterior y anterior (Vídeo 1).
Vídeo 1. Tratamiento quirúrgico mediante vitrectomía via pars plana de un caso de glaucoma maligno.
Si el paciente es fáquico se realizará también una facoemulsificación con implante de lente intraocular, y en aquellos casos que presenten una cámara anterior muy estrecha iniciaremos la cirugía con una vitrectomía central previa para conseguir aumentar la profundidad de la misma45,46.
Resulta imprescindible recordar el riesgo ya descrito del ojo adelfo a sufrir también el síndrome, debiendo instaurar tratamiento cicloplégico inmediato posterior a cualquier procedimiento láser o quirúrgico oftalmológico realizado. En caso de precisar cirugía de facoemulsificación podría estar indicado realizar una vitrectomía central con capsulohialoidectomía periférica de forma profiláctica.
Conclusiones
El síndrome misdireccional es una patología poco frecuente, relacionada en la mayoría de los casos a cirugía filtrante de glaucoma. Se deben conocer y estudiar de antemano los factores de riesgo favorecedores en los pacientes candidatos a cirugía, para intentar reducir su incidencia y reconocer de forma precoz el cuadro cuando se establezca. Cualquier medida terapéutica deberá tomarse de inmediato, intentando seguir los escalones terapéuticos establecidos y recurriendo a la cirugía de vítreorretiniana siempre que sea preciso.Bibliografía
- Levene R. A new concept of malignant glaucoma. Arch Opthalmol. 1972;87:497-506
- Von Graefe A. Beitrage zur pathologie und therapie des glaukoms. Archives of Ophthalmology. 1869;5:108.
- Zhang WZ, Huang L, Ma J, et al. Retrospective clinical analysis of 118 cases with malignant glaucoma. Zhongua yan ke za zhi. 2013;49:126-9.
- Hanish SK, Lamberg RL, Gordon JM. Malignant glaucoma following cataract surgery and intraocular lensimplant. Ophtalmic Surg. 1982;13:713-4.
- Duy TP, Wollensak J.Ciliary block (malignant) glaucoma following posterior chamber lens implantation. Ophtalmic Surv. 1987;18:741-4.
- Kodjikian L, Gain P, Donate D, et al. Malignant glaucoma induced by phakic posterior chamber intraocular lens for myopia.
- Rumelt S, Berskudsky V, Blum-Hareuveni T, et al. Preexisting and postoperative glaucoma in repeated corneal transplantation. Cornea. 2002;21:759-65.
- Greenlee EC, Kwon YH. Graft failure: III. Glaucoma escalation after penetrating keratoplasty. Int Ophthalmol. 2008;28:191-207.
- Zacharia PT, Abboud EB. Recalcitrant malignant glaucoma following pars plana vitrectomy, scleral buckle, and extracapsular cataract extraction with posterior chamber intraocular implantation. Ophthalmic Surg Lasers. 1998;29;323-7.
- Koukkoulli A, Rahman R. An unusual presentation of aqueous misdirection. Eye (Lond). 2013;27:675-6.
- Greenfield DS, Tello C, Budenz DL, et al. Aqueous misdirection after glaucoma drainage device implantation. Ophthalmology. 1999;106;1035-40.
- Martinez-de-la-casa JM, Garcia-Feijoo J, Castillo A, et al. Malignant glaucoma following combined Ahmed valve implant and phacoemulsification surgery for chronic angle-closure glaucoma. Arch Soc Esp Oftalmol. 2005;80:667-70.
- Arya SK, Sonika, Kochhar S, et al. Malignant glaucoma as a complication of Nd: YAG laser posterior capsulotomy. Ophthal Vis Sci. 2012;53:7813-8.
- Robinson A, Prialnic M, Deutch D, Savir H. The onset of malignant glaucoma afterprophylactic laser iridotomy.Am J Ophtalmol. 1990;110:95-6.
- Hardten DR, Brown JD. Malignant glaucoma after Nd:YAG cyclophotocoagulation. Am J Ophtalmol. 1991;111:245-7
- Gonzalez F, Sanchez-Salorio M, Pacheco P. Simultaneous bilateral “malignant glaucoma” attack in a patient with no antecedent eye surgery or miotics. Eur J Ophthalmol. 1992;2:91-3.
- Jarade EF, Dirani A, Jabbour E, et al. Spontaneous simultaneous bilateral malignant glaucoma of a patient with no antecedent history of meical or surgical eye disease. Clin Ophthalmol. 2014;8:1047-50.
- Mathur J, Slobodda J, Grehn F, et al. Malignant glaucoma following needling of trabeculectomy bleb. Eye (Lond). 2002;6:1959-66.
- Jacony B, Reed JW, Cashweel LF. Malignant glaucoma in a patient with Down’s syndrome and corneal hydrops. Am J Ophthalmol. 1990;110:434-5.
- Kushner BJ. Ciliary block glaucoma in retinopathy of prematurity. Arch Ophthalmol. 1982;100:1078-9.
- Weber PA, Cohen JS, Baker ND. Central retinal vein occlusion and malignant glaucoma. Arch Ophthalmol. 1987;105 635-6.
- Wang Z, Huang J, Lin J, et al. Quantitative mesurements of the ciliary body in eyes woth malignant glaucoma after trabeculectomy using ultrasound biomicroscopy. Ophthalmology. 2014;121:862.
- Ruben S, Tsai J Hitchings R. Malignant glaucoma and its management. British Journal of Ophtalmology. 1997;81:162-167
- Day AC, MacLaren RE, Bunce C, et al. Outcomes of phacoemulsification and intraocular lens implantation in microphtalmos and nanophtalmos. J Cataract Refract Surg. 2013;39:87-96.
- Ueda J, Sawagucki S, Kanazawa S, et al. Plateau iris configuration as a risk factor for malignant glaucoma. Nippon Ganka Gakkai Zasshi. 1997;101:723-9.
- Birge HL. Malignant glaucoma. Trans Am Ophthalmol Soc. 1956;54:311-28.
- Chandler PA. Malignant glaucoma. Trans Am Ophthalmol Soc. 1950;48:128-43.
- Fellman R, Budenz D. Malignant glaucoma. J Glaucoma. 1999;8:149-53.
- Saunders PP, Douglas GR, Feldman F, et al. Bilateral malignant glaucoma. Can J Ophthalmol. 1992;27:19-21.
- Shaffer RN. Role of vitreous detachment in aphakic and malignant glaucoma. Trans Am Acad Ophtalmol Otolaryngol. 1954;58:217-31.
- Mortada A. Engorgement of choroidal vessels and malignant glaucoma. Bull Ophtalmol Soc Egypt. 1971;64:141-4.
- Quigley HA, Friedman DS, Congdon NG. Possible mechanisms of primary angle-closure and malignant glaucoma. J Glaucoma. 2003;17:441167-80.
- Kaplowitz K, MD, Yuong E, et al. Current concepts in the treatment of vitreous block, also known as aqueous misdirection. Surv Ophtalm. 2015;60:229-41.
- Updegraff SA, Peyman GA, McDonald MB. Pupillary block during cataract surgery. AM J Ophthalmol. 1994;117:328-32.
- Berger RR, Kenteres AM, Powell DA. Suspected ciliary block associated with Viscoat use. J Cataract Refract Surg. 1999;43:388-99.
- Rajaraman R, Singh S, Raghavan A. Malignant glaucoma after intracameral perfluoropropane tamponade fot the management of acute corneal hydrops. Cornea, 2010;29:838-9.
- Golez E 3rd, Latina M. The use of anterior segment imaging after trabeculectomy. Semin Ophthalmol. 2012;27:155-9.
- Debrouwere V, Stalmans P, Van Calster J, et al. Outcomes of different management options for malignant glaucoma: a retrospective study. Graefes Arch Clin Exp Ophthalmol. 2012;250:131-41.
- Suprun AV, Fedorova SM. 50 Cases of malignant glaucoma. Vestn Oftalmol. 1982;66-7.
- Epstein DL, Steiert RF, Puliafito CA. Neodymium-YAG laser therapy to the anterior hyaloid in aphakic malignant (ciliovitreal block) glaucoma. Am J Ophtalmol. 1984;98:137-43.
- Little B, Hitchings RA. Pseudophakicmalignant glaucoma: Nd-YAG capsulotomy as primarytreatment. Eye. 1993;7:102-4.
- Little BC. Treatment of aphakic malignant glaucoma usind:YAG laser posterior capsulotomy. Br J Ophthalmol. 1994;78:499-501.
- Tomey KF, Traverso CE. Neodymium-YAG laser posterior capsulotomy for the treatment of aphakic and pseudophakic pupillary block. Am J Ophthalmol. 1987;104:502-7.
- Tsai YY, Tseng SH. Combined trabeculectomy and vitrectomy for pseudophakic malignant glaucoma and extensive peripheral anterior synechia-induced secondary glaucoma. J Cataract Refract Surg. 2004;30:715-7.
- Harbour JW, Rubsamen PE, Palmberg P. Pars plana vitrectomy in the management of phakic and pseudophakic malignant glaucoma. Arch Ophthalmol. 1996;114:1073-8.
- Bitrian E, Caprioli J. Pars plana anterior vitrectomy, hyaloido-zonulectomy and iridectomy for aquous humor misdirection. Am J Ophthalmol. 2010;150:82-7.