Volumen 22 - Número 5 - Diciembre 2014
Autofluorescencia del fondo ocular en las uveítis posteriores
A. Fonollosa
Unidad de Uveítis. Servicio de Oftalmología. Hospital Universitario Cruces. Baracaldo (Vizcaya).
CORRESPONDENCIA
Alex Fonollosa
E-mail: afonollosacalduch@gmail.com
E-mail: afonollosacalduch@gmail.com
Introducción
La autofluorescencia del fondo ocular (AFF) es una técnica diagnóstica de imagen de introducción relativamente reciente en la práctica clínica. Se trata de una prueba muy atractiva por la información que aporta, relacionada con el estado fisiometabólico del epitelio pigmentario de la retina (EPR) fundamentalmente, y por el hecho de ser no invasiva, sencilla y rápida de realizar. La presente revisión se centra en el papel de la AFF en el manejo de las uveítis posteriores, valorando los trabajos existentes en la literatura y también aportando la experiencia en el Hospital Universitario de Cruces. Hay que decir que no es objetivo de esta revisión exponer de manera detallada y exhaustiva los fundamentos técnicos (modos de captar imágenes) ni físico-bioquímicos de la AFF. Sin embargo, se ha considerado conveniente revisar de manera somera algunos conceptos básicos relacionados con el origen de la fluorescencia espontánea de las estructuras del fondo de ojo. Se comentará la AFF para longitud de onda corta, que es la más extendida en la práctica clínica habitual.Epitelio pigmentario de la retina, lipofuscina y autofluorescencia
La AFF se basa en las propiedades autofluorescentes de la lipofuscina, material complejo presente en diversas células del organismo, especialmente en las células posmitóticas metabólicamente activas, como los miocitos cardiacos, determinadas neuronas y el EPR. En estas, su acumulación se relaciona con el envejecimiento y la enfermedad. La lipofuscina deriva de la digestión de los segmentos externos de los fotorreceptores. El hecho de que se acumule en los lisosomas apoya la consideración de que este material representa la degradación incompleta de macromoléculas internalizadas. La cantidad de lipofuscina, y por lo tanto la intensidad de la autofluorescencia, están aumentadas con la disfunción del EPR. La pérdida de fotorreceptores tiene como consecuencia una disminución de la cantidad de lipofuscina en el EPR y, por tanto, una disminución de la intensidad de la autofluorescencia de estas células. La lipofuscina está compuesta por muchos fluoróforos derivados de precursores retinoides, de los cuales el más importante probablemente sea el A2E (N-retinilideno-N-retinil- etanolamina)1,2.Autofluorescencia de la retina externa y del espacio subretiniano
Hay que señalar que determinadas enfermedades se caracterizan por un aumento de la autofluorescencia que no emana del EPR sino de la retina externa y del espacio subretiniano. Los mecanismos subyacentes son los siguientes3:- Los retinoides no llegan al EPR por un incorrecto transporte a través de los segmentos externos, como ocurre en la enfermedad de Stargardt. En este caso se producen y acumulan derivados no deseados de retinoides dentro de los segmentos externos. Estos derivados son autofluorescentes y potencialmente tóxicos.
- Existe una separación física del EPR y de los segmentos externos de los fotorreceptores. En condiciones normales estos se desprenden y son fagocitados por el EPR, pero en enfermedades con la característica mencionada los segmentos externos permanecen en el espacio subretiniano y se cree que son la fuente de la autofluorescencia. Esta puede deberse a lipofuscina generada en otras células, como los macrófagos, o bien a un incorrecto metabolismo extracelular de retinoides de los segmentos externos de los fotorreceptores.
Inflamación corioretiniana y AFF
En la patogenia de muchas uveítis posteriores tiene un papel central el daño a las células del EPR, por lo que cabe presumir que se produzcan alteraciones de la autofluorescencia en estas enfermedades. La agresión inflamatoria de las células del EPR produciría disfunción enzimática lisosomal, a través del incremento del estrés oxidativo y otros mecanismos, y por lo tanto aumento de la lipofuscina. En las fases finales del proceso inflamatorio se produce atrofia del EPR, lo que se traduciría en una disminución de la autofluorescencia4.También cabe considerar que los mecanismos de incremento de la autofluorescencia relacionados con la alteración de la retina externa y del espacio subretiniano desempeñen un papel en las uveítis posteriores. A continuación se detallan los hallazgos de AFF más relevantes de diferentes tipos de uveítis posteriores.
Coriorretinopatía en perdigonada (birdshot)
La coriorretinopatía en perdigonada (birdshot) es una uveítis posterior crónica bilateral, caracterizada por la presencia de lesiones redondeadas u ovaladas hipopigmentadas coroideas acompañadas de vitritis leve, vasculitis y papilitis. La AFF en esta enfermedad se ha descrito en varias publicaciones5-7. Los spots o zonas hipoautofluorescentes eran las alteraciones más frecuentes. Un hecho a destacar es que, aunque algunas de estas se correspondían con las lesiones hipopigmentadas observadas en la funduscopia, la mayoría no lo hacían y se observaban más alteraciones en la AFF que en la funduscopia. Otro hallazgo bastante común fue la hipoautofluorescencia circunferencial alrededor del disco óptico, que se correspondía con atrofia corioretiniana en la funduscopia. Finalmente, en algunos pacientes se halló hipoautofluorescencia o hiperautofluorescencia a lo largo de los vasos retinianos.Los spots y áreas hipoautofluorescentes en la coriorretinopatía en perdigonada se han atribuido a atrofia del EPR. La no correspondencia entre estas alteraciones y las lesiones tipo perdigonada de la funduscopia apunta a que el EPR y la coroides pueden afectarse independientemente en la coriorretinopatía en perdigonada, hipótesis patogénica ya planteada por varios autores. En relación a la hipoautofluorescencia a lo largo de los vasos, Koizumi et al.5 la han atribuido también a atrofia del EPR. Para estos autores, los vasos retinianos contribuirían al daño del EPR mediante el aporte de células inflamatorias y/o anticuerpos hacia el ojo.
Enfermedad de Vogt-Koyanagi-Harada
La enfermedad de Vogt-Koyanagi-Harada (VKH) es una panuveítis granulomatosa bilateral cuyo rasgo clínico fundamental en la fase aguda es el desprendimiento de retina seroso. La fase crónica se caracteriza por uveítis anterior recurrente, y en el segmento posterior por una despigmentación de la coroides. La AFF en esta enfermedad se ha descrito en diversas publicaciones8-11. Koizumi et al.8 describieron las alteraciones en la AFF desde la fase de desprendimiento seroso hasta la resolución de este en cinco pacientes. Los desprendimientos de la mácula se observaban como hiperautofluorescencia macular con algunas áreas de hipoautofluorescencia en su seno en cuatro pacientes, y solamente hiperautofluorescencia en uno. Dos de estos pacientes, en quienes se instauró tratamiento con pulsos de corticoesteroides inmediatamente después del inicio de los síntomas, las alteraciones de la AFF se resolvieron a los 6 meses. Sin embargo, en los otros tres, en quienes el tratamiento se retrasó o fue inicialmente insuficiente, a los 6 meses y con la retina totalmente aplicada, la AFF mostraba alteraciones como hiperautofluorescencia granular y en placas, spots hipoautofluorescentes e hiperautofluorescencia radial (esta última correspondiente a pliegues coroideos). La hiperautofluorescencia observada en las fases de desprendimiento seroso se atribuyó a disfunción del EPR secundaria a inflamación coroidea. La hiperautofluorescencia granular observada a los 6 meses correspondía a un engrosamiento multifocal del EPR según la OCT, y la hiperautofluorescencia placoide se correlacionaba con una disrupción de la banda de los elipsoides y un EPR normal, sugiriendo este último hallazgo una disfunción del EPR que afectaba la capa de fotorreceptores.Ayata et al.9 describieron las alteraciones en la AFF en un solo caso de VKH: los desprendimientos serosos se mostraban como hipoautofluorescentes, lo que atribuyen a un efecto bloqueo del fluido subretiniano.
Vasconcelos-Santos et al.10 describieron las alteraciones en la AFF y en la tomografía de coherencia óptica de dominio espectral (SD-OCT) de siete pacientes en fase crónica (media de 46 meses tras el inicio). Ningún ojo mostró alteraciones en la AFF ni en la OCT en las zonas de despigmentación coroidea (sunset-glow). Las cicatrices corioretinianas en forma de halo peripapilar o numulares se observaron como lesiones hipoautofluorescentes que se correspondían con atrofia del EPR y disrupción variable de la retina externa en la OCT. El componente pigmentado que se observaba en algunas de estas alteraciones se observaba como engrosamiento del EPR en la OCT y alteraciones variables de la retina externa. Las lesiones hiperautofluorescentes se correspondieron con una amplia variedad de alteraciones en la OCT: engrosamiento del EPR sin afectación de la retina externa (la integridad de esta explica el aumento de la autofluorescencia en este caso), disrupción de la banda de los elipsoides, irregularidades en la cara interna del EPR y edema macular quístico.
La AFF puede aportar información útil para el manejo terapéutico de los pacientes con VKH. Esta técnica de imagen puede mostrar alteraciones indicativas de agresión y disfunción del EPR, probablemente secundarias a inflamación coroidea persistente, aun tras la reabsorción del fluido subretiniano.
Coroiditis multifocal y panuveítis
La coroiditis multifocal con panuveítis (CMP) es un tipo de enfermedad inflamatoria intraocular típica de mujeres miopes jóvenes. Sus rasgos clínicos característicos incluyen la presencia de lesiones corioretinianas atróficas redondeadas de distribución difusa o lineal, cicatrización peripapilar, frecuencia alta de neovascularización coroidea y episodios de inflamación intraocular que consisten en vitritis e infiltrados coroideos. La información más relevante sobre la utilidad de la AFF en esta enfermedad es la que aportan Haen y Spaide12. De los 18 pacientes de su serie, en 11 realizan retinografías y AFF seriadas a lo largo de una media de 18 meses. Estos autores observan que el desarrollo de nuevas lesiones visibles en la funduscopia se produce en áreas donde en exploraciones previas se observaban alteraciones sólo en la AFF. Es decir, los hallazgos en la AFF precedían a los hallazgos funduscópicos. Dichas alteraciones consistían en spots hipoautofluorescentes de menos de 125 µm. Este hallazgo es de gran utilidad en términos de valoración de la actividad inflamatoria en la CMP. La Figura 1 muestra imágenes de una paciente seguida en nuestra unidad.
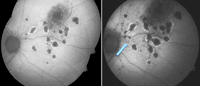
Figura 1. Paciente afecta de coroiditis multifocal con panuveítis. La flecha muestra el desarrollo de lesiones aun estando asintomática.
Coroiditis serpiginosa clásica y coroiditis multifocal serpiginoide
La coroiditis serpiginosa clásica (CSC) es una enfermedad inflamatoria de la coriocapilar y la retina externa bilateral, que afecta con más frecuencia a hombres en edades medias, de patogenia desconocida. Las alteraciones en la AFF se han descrito en algunas publicaciones13,14. Piccolino et al.13 han realizado la descripción más completa de los cambios que suceden en la AFF desde el periodo agudo hasta la quiescencia de la lesión. Las alteraciones consisten en: 1) granularidad levemente hipoautofluorescente sin bordes nítidos; 2) hiperautofluorescencia clara con granularidad hipoautofluorescente y bordes hipoautofluorescentes; y 3) progresiva transformación en una hipoautofluorescencia total. Nuestras observaciones coinciden plenamente con la de estos autores.La AFF permite observar la progresiva inactivación de las lesiones en la CSC. En nuestra opinión, las imágenes de AFF son menos equívocas que las retinográficas o angiográficas en términos de valoración del proceso de dicha inactivación. La Figura 2 muestra la típica evolución de las lesiones en la AFF de una paciente controlada en nuestra unidad.
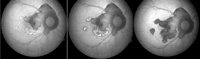
Figura 2. Típica evolución de las lesiones en un caso de coroiditis serpiginosa.
La coroiditis multifocal serpiginoide (CMS) es similar a la CSC, pero se presenta en pacientes más jóvenes y se asocia presuntamente a tuberculosis. Suele manifestarse como lesiones de coroiditis multifocal coalescentes y con un frente de progresión muy parecido a la CSC. A diferencia de esta, no suelen partir del disco óptico.
Gupta et al.15 han clasificado los cambios en la AFF en esta enfermedad en cuatro estadios:
- Agudo: las lesiones cremosas amarillentas se aprecian en la AFF como normofluorescentes o hipofluorescentes rodeadas de un halo de hiperautofluorescencia.
- Subagudo: al cabo de 2 a 4 semanas el halo de hiperautofluorescencia es sustituido por un anillo de hipoautofluorescencia y el centro de la lesión es predominantemente hiperautofluorescente con puntos hipoautofluorescentes.
- Resolución parcial: entre 6 y 8 semanas después del inicio, la lesión muestra hipoautofluorescencia casi total.
- Resolución completa: varios meses después del inicio, la lesión se aprecia totalmente hipoautofluorescente.
La correlación de los hallazgos de la AFF con los de la SD-OCT ayuda a comprender los diferentes tipos de señales de la AFF. En la fase aguda se produce un incremento de la actividad metabólica secundaria a la inflamación primaria del EPR. La liberación de mediadores inflamatorios hacia la retina externa induce edema en esta, que se observa como hiperreflectividad mal delimitada. Tras el episodio inflamatorio agudo, las células del EPR sufren hipertrofia e hiperplasia que se observa como hiperautofluorescencia y corresponde a pequeñas protuberancias hiperreflectivas en la SD-OCT. La progresiva hipoautofluorescencia se debe a la pérdida de los fotorreceptores y la atrofia del EPR.
La AFF contribuye de manera determinante a la valoración de la actividad inflamatoria también en la CMS. Durante las fases de resolución incompleta, en las que la funduscopia muestra aparente quiescencia y las imágenes angiográficas pueden no ser muy claras, el patrón de hiperautofluorescencia con puntos hipoautofluorescentes refleja actividad metabólica y, por tanto, actividad inflamatoria subclínica persistente en las lesiones aparentemente quiescentes. No hay duda de que las técnicas angiográficas ponen de manifiesto claramente las reactivaciones de lesiones cicatriciales. En este caso, la AFF aporta información complementaria sobre la actividad inflamatoria de la enfermedad.
Edema macular uveítico
La sensibilidad de la AFF para detectar el edema macular es inferior a la de la SD-OCT. Roessel et al.17 hallaron cambios en la AFF sólo en el 50% de sus pacientes con edema macular tomográfico. Las alteraciones consistían en una hiperautofluorescencia en el área foveal que podría deberse al desplazamiento de los pigmentos maculares por los quistes, que conllevaría un desenmascaramiento de la autofluorescencia del EPR subfoveal (Figura 3).

Figura 3. Imagen de edema macular uveítico: típica hiperautofluorescencia foveal.
Otras enfermedades
Los hallazgos en la AFF también se han descrito para otras afecciones inflamatorias del polo posterior, como la epiteliopatía placoide posterior multifocal aguda18,19, la AZOOR (Acute Zonal Occult Outer Retinopathy)7,20, el síndrome de múltiples puntos blancos evanescentes21,22 y enfermedades infecciosas como la coriorretinitis pseudoplacoide sifilítica23, la retinitis por citomegalovirus24 y la necrosis retiniana externa progresiva25, ayudando en algunos casos a objetivar más claramente que con las técnicas de imagen estándar la evolución de la enfermedad.Conclusiones
En las uveítis posteriores la AFF puede ser útil fundamentalmente por dos motivos:- Ayuda a comprender la patogenia de la enfermedad: en este sentido, la combinación con la SD-OCT resulta muy fructífera. Hay que señalar que no son pocos los autores que establecen la equivalencia hipoautofluorescencia = atrofia del EPR. La SD-OCT permite comprobar si esto es así o si, por ejemplo, existe infiltrado inflamatorio en la retina externa que ejerce efecto pantalla y es el causante en realidad de la disminución de la autofluorescencia.
- Permite valorar mejor la actividad inflamatoria de las lesiones y su verdadera extensión: en algunas situaciones la AFF puede predecir el desarrollo de lesiones visibles en la funduscopia, como en la CMP; en otras, como la CSC y la CMS, informa de manera más precisa que las técnicas angiográficas sobre el estado inflamatorio de las lesiones en proceso de inactivación. Es frecuente que, como ocurre en la CMP, la AFF muestre más lesiones que la funduscopia.
Bibliografía
- Schmitz-Valckenberg S, Holz FG, Bird AC, Spaide RF. Fundus autofluorescence imaging. Review and perspectives. Retina. 2008;28:385-409.
- Sparrow JR, Boulton M. RPE lipofuscin and its role in retinal pathobiology. Exp Eye Res. 2005;80:595-606.
- Spaide R. Autofluorescence from the outer retina and subretinal space. Retina. 2008;28:5-35.
- Xu H. Lipofuscin and autofluorescence in experimental animal models. En: Lois N, Forrester JV, editors. Fundus autofluorescence, 1st ed. Philadelphia: Lippincott Williams & Wilkins; 2009. p. 38-47.
- Koizumi H, Pozzoni MC, Spaide RF. Fundus autofluorescence in birdshot chorioretinopathy. Ophthalmology. 2008;115:e15-e20.
- Giuliari GP, Hinkle DM, Foster CS. The spectrum of fundus autofluorescence findings in birdshot chorioretinopathy. J Ophthalmol. 2009;2009:567-693.
- Yeh S, Forooghian F, Wong WT, Faia LJ, Cukras C, Lew JC, et al. Fundus autofluorescence imaging of the white dot syndromes. Arch Ophthalmol. 2010;128:46-56.
- Koizumi H, Maruyama K, Kinoshita S. Blue light and near-infrared fundus autofluorescence in acute Vogt-Koyanagi-Harada disease. Br J Ophthalmol. 2010;94:1499-505.
- Ayata A, Dogru S, Senol MG, Unal M, Ersanli D, Bilge AH. Autofluorescence findings in Vogt-Koyanagi-Harada disease. Eur J Ophthalmol. 2009;19:1094-7.
- Vasconcelos-Santos DV, Sohn EH, Sadda S, Rao NA. Retinal pigment epithelial changes in chronic Vogt-Koyanagi-Harada disease. Fundus autofluorescence and spectral domain-otical coherence tomography findings. Retina. 2010;30:33-41.
- Heussen FM, Vasconcelos-Santos DV, Pappuru RR, Walsh AC, Rao NA, Sadda SR. Ultra-wide-field green-light (532 nm) autofluorescence imaging in chronic Vogt-Koyanagi-Harada disease. Ophthalmic Surg Lasers Imaging. 2011;42:272-7.
- Haen SP, Spaide RF. Fundus autofluorescence in multifocal choroiditis and panuveitis. Am J Ophthalmol. 2008;145:847-53.
- Piccolino FC, Grosso A, Savini A. Fundus autofluorescence in serpiginous choroiditis. Graefes Arch Clin Exp Ophthalmol. 2009;247:179-85.
- Arantes TE, Matos K, García CR, Silva TG, Sabrosa AS, Muccioli C. Fundus autofluorescence and spectral domain optical coherence tomography in recurrent serpiginous coroiditis: case report. Ocul Immunol Inflamm. 2011;19:39-41.
- Gupta A, Bansal R, Gupta V, Sharma A. Fundus autofluorescence in serpiginouslike choroiditis. Retina. 2011;32:814-25.
- Bansal R, Kulkarni P, Gupta A, Gupta V, Dogra MR. High-resolution spectral domain optical coherence tomography and fundus autofluorescence correlation in tubercular serpiginouslike choroidopathy. J Ophthal Inflamm Infect. 2011;1:157-63.
- Roessel M, Henschel A, Heinz C, Dietzl M, Spital G, Heiligenhaus A. Fundus autofluorescence and spectral domain optical coherence tomography in uveitic macular edema. Graefes Arch Clin Exp Ophthalmol. 2009;247:1685-9.
- Spaide RF. Autofluorescence imaging of acute posterior multifocal placoid pigment epitheliopathy. Retina. 2006;26:479-82.
- Souka AAR, Hillenkamp J, Gabel VP, Framme C. Correlation between optical coherence tomography and autofluorescence in acute posterior multifocal placoid pigment epitheliopathy. Graefes Arch Clin Exp Ophthalmol. 2006;244:1219-23.
- Fujiwara T, Imamura Y, Giovinazzo VJ, Spaide RF. Fundus autofluorescence and optical coherence tomographic findings in acute zonal occult outer retinopathy. Retina. 2010;30:1206-16.
- Furino C, Boscia F, Cardascia N, Alessio G, Sborgia C. Fundus autofluorescence and multiple evanescent white dot syndrome. Retina. 2009;29:60-63.
- Dell’Omo, R, Mantovani A, Wong R, Konstantopoulou K, Kulwant S, Pavesio CE. Natural evolution of fundus autofluorescence findings in multiple evanescent white dot syndrome. A long term follow-up. Retina. 2010;30:1479-87.
- Bellmann C, Holz FG, Breitbart A, Völcker HE. Bilateral acute syphilitic posterior placoid chorioretinopathy: angiographic and autofluorescence characteristics. Ophthalmologe. 1999;96:522-8.
- Yeh S, Forooghian F, Faia LJ, Weichel ED, Wong WT, Sen HN, et al. Fundus autofluorescence changes in cytomegalovirus retinitis. Retina. 2010;30:42-50.
- Yeh S, Wong WT, Weichel ED, Lew JC, Chew EY, Nussenblatt RB. Fundus autofluorescence and OCT in the management of progressive outer retinal necrosis. Ophthalmic Surg Lasers Imaging. 2010;9:1-4.