Volumen 22 - Número 5 - Diciembre 2014
Autofluorescencia en la coriorretinopatía serosa central
A. Burés Jelstrup, R. Navarro
Instituto de Microcirugía Ocular. Barcelona.
CORRESPONDENCIA
Anniken Burés Jelstrup
E-mail: bures@imo.es
E-mail: bures@imo.es
La retinografía con filtro de autofluorescencia es una técnica de imagen relativamente reciente, rápida y no invasiva, que ofrece datos directos sobre el metabolismo de las células retinianas. La autofluorescencia permite detectar los fluoróforos (sustancias con propiedades autofluorescentes) intrínsecos de la retina, que son mayoritariamente productos derivados del metabolismo celular retiniano, en especial de los segmentos externos de los fotorreceptores. Por este motivo, los fluoróforos típicamente se acumulan en el epitelio pigmentario de la retina (EPR), aunque en determinadas ocasiones pueden detectarse también en la retina externa o en el espacio subretiniano.
El espacio entre el EPR y los fotorreceptores es precisamente un campo en el que se producen múltiples fenómenos metabólicos de vital importancia para la homeostasis retiniana, y por ello la autofluorescencia aporta una visión in vivo del grado de salud y del funcionamiento de las células retinianas. Estas alteraciones en la homeostasis del complejo EPR-fotorreceptores son importantes en el diagnóstico y el seguimiento de varias patologías retinianas, entre ellas la coriorretinopatía serosa central (CSC).
Uno de los principales productos derivados del metabolismo de los fotorreceptores es la lipofuscina, que contiene varios fluoróforos (los más importantes son A2E y A2-PE) y, por tanto, su presencia puede detectarse mediante técnicas de autofluorescencia. El proceso de envejecimiento normal de la retina conlleva un acúmulo progresivo de lipofuscina en las células del EPR, y con ello un aumento progresivo de la autofluorescencia retiniana que se considera fisiológica. En cambio, como se verá más adelante, las lesiones hiperautofluorescentes suelen asociarse a zonas de disfunción metabólica a nivel del EPR o en los fotorreceptores, mientras que las zonas hipoautofluorescentes suelen traducir atrofia del EPR (y por tanto ausencia de autofluorescencia).
En la mayoría de los casos, la CSC suele ser un cuadro autolimitado con buena recuperación anatómica y visual dentro de los 3 a 6 primeros meses, aunque pueden persistir leves alteraciones del EPR sin traducción funcional2,3. Sin embargo, en algunos pacientes se produce una cronificación del proceso, que puede llevar a pérdida de visión y daño retiniano irreversible.
A medida que va progresando la enfermedad y persiste el fluido subretiniano, pueden empezarse a apreciar las primeras alteraciones en la autofluorescencia. Típicamente se observa una hiperautofluorescencia homogénea progresiva, con cierta tendencia al acúmulo gravitacional y que delimita el borde inferior del desprendimiento4 (Figura 2 y Figura 3).
A medida que progresa el cuadro se observan unos pequeños puntos hiperautofluorescentes que otorgan un aspecto granular a la lesión (Figura 4 y Figura 5). Existe controversia acerca de si estos puntos hiperautofluorescentes se corresponden o no con los depósitos blanco-amarillentos a nivel del espacio subretiniano visibles por fundoscopia convencional. Se cree que estos depósitos podrían ser macrófagos engrosados por el acúmulo de segmentos externos fagocitados5,6. También se ha propuesto que estos depósitos podrían ser lípidos o fibrina, pero estos no tienen propiedades autofluorescentes, con lo que no explican la hiperautofluorescencia observada. Estudios realizados mediante tomografía de coherencia óptica (OCT) de alta resolución sugieren que los puntos hiperautofluorescentes podrían corresponder a los segmentos externos elongados de los fotorreceptores5,7, lo cual justifica que se observe autofluorescencia no sólo a nivel del EPR sino también en la retina externa6.
En conclusión, es posible que existan componentes que puedan producir lesiones hiperautofluorescentes (como el acúmulo de segmentos externos en los macrófagos y los segmentos externos elongados). Por otro lado, la presencia continuada de fluido subretiniano puede conducir a la presencia de lípidos y fibrina en el espacio subretiniano, y si bien estas sustancias no tienen propiedades autofluorescentes, sí pueden observarse como depósitos blanco-amarillentos en el espacio subretiniano.
La hiperautofluorescencia que se observa en las fases más agudas de la CSC tiende a desaparecer progresivamente en cuanto se reabsorbe el fluido subretiniano. Como se verá más adelante, cuando la enfermedad no se resuelve, o cuando recidiva de forma repetida, empiezan a aparecer cambios de naturaleza irreversible en la autofluorescencia.
La hiperautofluorescencia progresiva traduce una dificultad también progresiva del EPR para eliminar los segmentos externos fagocitados, y este proceso, a su vez, es proporcional a la duración del cuadro. Así, cuanto más crónico es el desprendimiento, mayor es el grado de hiperautofluorescencia. Spaide y Klancnik6 observaron que estas zonas de mayor hiperautofluorescencia se correspondían con áreas de acúmulo de material en la superficie externa de la retina en la OCT. Matsumoto et al.5 demostraron, en un estudio posterior, que lo que se creía que eran depósitos subretinianos se correspondían en realidad con los segmentos externos elongados de los fotorreceptores5.
Tanto la presencia de fluido crónico como la presencia de fluoróforos en el espacio subretiniano pueden contribuir al daño progresivo de las células del EPR y de los fotorreceptores7,9.
Como ya se ha mencionado, existen varios patrones de hipoautofluorescencia que denotan el daño del EPR en los casos de CSC crónica. Aunque es una enfermedad heterogénea y existe gran variedad de fenotipos clínicos, se ha propuesto una clasificación que divide los casos en tres grupos: hipoautofluorescencia granular, hipoautofluorescencia confluente y tractos descendentes hipoautofluorescentes8 (Figura 9). Como parece lógico, los estudios de correlación entre autofluorescencia y OCT demuestran que las áreas de hipoautofluorescencia se corresponden con zonas de atrofia del EPR y de la retina externa en la OCT6 (Figura 10).
Pero la autofluorescencia no sólo permite reconocer la fisiopatología de la enfermedad y los cambios celulares, sino que también hace posible predecir en cierto grado el pronóstico visual final del paciente en función del patrón de autofluorescencia6,10,11. Así, el patrón de hipoautofluorescencia granular y confluente se correlaciona claramente con peores resultados visuales, mientras que la hiperautofluorescencia no parece correlacionarse de forma estadísticamente significativa con un pronóstico visual determinado8.
Ojima et al.14 estudiaron casos de CSC con densitometría y encontraron una reducción de la densidad de fotopigmentos en el área de desprendimiento en las CSC agudas, siendo normal la retina circundante. Vieron también que, al resolverse el desprendimiento seroso, persistía la reducción de fotopigmentos en el área previamente afectada, y esto podía correlacionarse de manera adecuada con las alteraciones en la línea de los elipsoides observadas en la OCT. Con el tiempo se produce una recuperación progresiva de la densidad de fotopigmentos hasta valores previos. Esta recuperación lenta, posterior a la reabsorción del fluido, podría explicar los síntomas que presentan los pacientes (escotoma relativo, alteración en la visión de los colores, etc.) a pesar de la resolución del desprendimiento seroso14.
Como ya se ha mencionado, la autofluorescencia más utilizada en la práctica clínica es la luz azul de longitud de onda corta. Este tipo de luz estimula principalmente los fluoróforos contenidos en la lipofuscina y, por tanto, detecta la presencia o la ausencia de ésta en las células de la retina. En cambio, la autofluorescencia infrarroja estimula la melanina contenida en las capas del EPR y la coroides. La melanina tiene un efecto protector sobre los fotorreceptores y las células del EPR (por sus propiedades antioxidantes y su efecto fotoprotector), y por este motivo, medir las concentraciones de melanina en estos tejidos puede tener implicaciones clínicas, tanto diagnósticos como en el seguimiento15.
En los estudios realizados por Sekiryu et al.16 se encontró que pequeñas lesiones compatibles con acúmulos de células del EPR producían hiperautofluorescencia, tanto con autofluorescencia de onda corta como con autofluorescencia infrarroja. En cambio, algunas lesiones puntiformes hiperautofluorescentes con autofluorescencia de onda corta no lo eran con autofluorescencia infrarroja, lo cual podría deberse a una lesión más directa del fotorreceptor (que no contiene melanina, pero sí lipofuscina).
Estas nuevas modalidades diagnósticas están todavía en fases iniciales y es pronto para determinar sus implicaciones, aunque lo que sí parece cierto es que la combinación de ambas técnicas de forma simultánea podría aportar detalles anatómicos y celulares más precisos que cada una de ellas por separado.
El espacio entre el EPR y los fotorreceptores es precisamente un campo en el que se producen múltiples fenómenos metabólicos de vital importancia para la homeostasis retiniana, y por ello la autofluorescencia aporta una visión in vivo del grado de salud y del funcionamiento de las células retinianas. Estas alteraciones en la homeostasis del complejo EPR-fotorreceptores son importantes en el diagnóstico y el seguimiento de varias patologías retinianas, entre ellas la coriorretinopatía serosa central (CSC).
Uno de los principales productos derivados del metabolismo de los fotorreceptores es la lipofuscina, que contiene varios fluoróforos (los más importantes son A2E y A2-PE) y, por tanto, su presencia puede detectarse mediante técnicas de autofluorescencia. El proceso de envejecimiento normal de la retina conlleva un acúmulo progresivo de lipofuscina en las células del EPR, y con ello un aumento progresivo de la autofluorescencia retiniana que se considera fisiológica. En cambio, como se verá más adelante, las lesiones hiperautofluorescentes suelen asociarse a zonas de disfunción metabólica a nivel del EPR o en los fotorreceptores, mientras que las zonas hipoautofluorescentes suelen traducir atrofia del EPR (y por tanto ausencia de autofluorescencia).
Aplicaciones de la autofluorescencia en la coriorretinopatía serosa central
La CSC es una patología de causa desconocida en la cual se producen una o varias zonas de levantamiento neurosensorial de la retina (generalmente en el área macular) y/o desprendimiento seroso del EPR debido a la presencia de un flujo exudativo anómalo a través del este. Se han propuesto varios factores de riesgo, pero ninguno que haya demostrado ser concluyente a día de hoy1.En la mayoría de los casos, la CSC suele ser un cuadro autolimitado con buena recuperación anatómica y visual dentro de los 3 a 6 primeros meses, aunque pueden persistir leves alteraciones del EPR sin traducción funcional2,3. Sin embargo, en algunos pacientes se produce una cronificación del proceso, que puede llevar a pérdida de visión y daño retiniano irreversible.
Coriorretinopatía serosa central aguda
El patrón de autofluorescencia difiere enormemente dependiendo de la cronicidad del cuadro. Las primeras alteraciones retinianas detectables mediante autofluorescencia no suelen aparecer hasta pasados 1 a 2 meses del inicio del cuadro. Además, en la fase aguda, la señal de autofluorescencia puede verse afectada tanto por la presencia del fluido subretiniano como por el desprendimiento seroso del EPR o la presencia de fibrina (cabe recordar que esta no presenta propiedades autofluorescentes)3 (Figura 1).
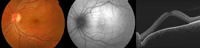
Figura 1. Corioretinopatía serosa central aguda de 3 semanas de evolución. La retinografía mediante filtro de autofluorescencia (imagen del centro) todavía no muestra prácticamente alteraciones. Además, la señal de autofluorescencia se ve afectada por la presencia del desprendimiento neurosensorial.
A medida que va progresando la enfermedad y persiste el fluido subretiniano, pueden empezarse a apreciar las primeras alteraciones en la autofluorescencia. Típicamente se observa una hiperautofluorescencia homogénea progresiva, con cierta tendencia al acúmulo gravitacional y que delimita el borde inferior del desprendimiento4 (Figura 2 y Figura 3).
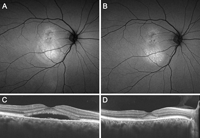
Figura 2. Caso de corioretinopatía serosa central (CSC) crónica con varias recidivas. Se aprecian en ambas imágenes de autofluorescencia (A y B) alteraciones granulares hiperautofluorescentes, típicas de los casos de CSC de evolución cronificada. En la imagen A (se corresponde a la tomografía de coherencia óptica C) se observa presencia activa de fluido, que en la autofluorescencia se ve como una zona de depósito gravitacional hiperautofluorescente inferior. En la imagen B (se corresponde con la tomografía D), el fluido está en fase de reabsorción y ya no se observa el mismo patrón gravitacional, aunque persisten las alteraciones hiperautofluorescentes (que no desaparecerán hasta pasadas varias semanas de la resolución del desprendimiento).

Figura 3. Corioretinopatía serosa central de varias semanas de evolución. Se observa en la autofluorescencia a nivel macular (B) una hipoautofluorescencia granular central (que traduce la cronicidad del cuadro) y una hiperautofluorescencia alrededor de la lesión central y en patrón descendente hacia la retina inferior (A), donde puede verse una acumulación de fluido de aspecto crónico. La angiografía fluoresceínica (C) muestra exudación activa de fluido a través del EPR, mientras que la tomografía de coherencia óptica (D) muestra un gran desprendimiento neurosensorial con extensión hacia la retina inferior.
A medida que progresa el cuadro se observan unos pequeños puntos hiperautofluorescentes que otorgan un aspecto granular a la lesión (Figura 4 y Figura 5). Existe controversia acerca de si estos puntos hiperautofluorescentes se corresponden o no con los depósitos blanco-amarillentos a nivel del espacio subretiniano visibles por fundoscopia convencional. Se cree que estos depósitos podrían ser macrófagos engrosados por el acúmulo de segmentos externos fagocitados5,6. También se ha propuesto que estos depósitos podrían ser lípidos o fibrina, pero estos no tienen propiedades autofluorescentes, con lo que no explican la hiperautofluorescencia observada. Estudios realizados mediante tomografía de coherencia óptica (OCT) de alta resolución sugieren que los puntos hiperautofluorescentes podrían corresponder a los segmentos externos elongados de los fotorreceptores5,7, lo cual justifica que se observe autofluorescencia no sólo a nivel del EPR sino también en la retina externa6.

Figura 4. Típicas alteraciones precoces en la autofluorescencia. En este caso de corioretinopatía serosa central de 2 meses de evolución se observa el típico patrón moteado o puntiforme hiperautofluorescente (B). Aunque con dificultad, en la retinografía (A) pueden verse también lesiones punteadas blanco-amarillentas, aunque en menor grado que en la autofluorescencia. Las puntas de flecha demarcan los bordes del levantamiento neurosensorial.
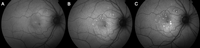
Figura 5. Progresión de los cambios en la autofluorescencia con el tiempo. En la imagen de la izquierda (A) se aprecia un levantamiento neurosensorial de 10 semanas de evolución. B) A los 3 meses de la primera imagen. C) A los 6 meses de la primera imagen. Se observa cómo van apareciendo de forma progresiva las lesiones hiperautofluorescentes características. Estas lesiones suelen aparecer cuando persiste el fluido bajo la retina. En este caso en concreto, el desprendimiento neurosensorial se fue reduciendo progresivamente, aunque no llegó a resolverse del todo.
En conclusión, es posible que existan componentes que puedan producir lesiones hiperautofluorescentes (como el acúmulo de segmentos externos en los macrófagos y los segmentos externos elongados). Por otro lado, la presencia continuada de fluido subretiniano puede conducir a la presencia de lípidos y fibrina en el espacio subretiniano, y si bien estas sustancias no tienen propiedades autofluorescentes, sí pueden observarse como depósitos blanco-amarillentos en el espacio subretiniano.
La hiperautofluorescencia que se observa en las fases más agudas de la CSC tiende a desaparecer progresivamente en cuanto se reabsorbe el fluido subretiniano. Como se verá más adelante, cuando la enfermedad no se resuelve, o cuando recidiva de forma repetida, empiezan a aparecer cambios de naturaleza irreversible en la autofluorescencia.
Coriorretinopatía serosa central crónica
A medida que se cronifica el desprendimiento neurosensorial, van apareciendo alteraciones en la autofluorescencia que reflejan el daño crónico sobre las células del EPR. Estas alteraciones pueden ir desde una leve granulación hipoautofluorescente hasta grandes áreas confluentes de hipoautofluorescencia. En algunas ocasiones incluso se observan tractos descendentes hipoautofluorescentes que traducen el flujo gravitacional crónico de fluido hacia la retina inferior (Figura 6 y Figura 7). Al tratarse de una enfermedad crónica con recidivas frecuentes, es habitual encontrar un patrón heterogéneo que combina tanto alteraciones hipoautofluorescentes como lesiones hiperautofluorescentes (estas últimas típicamente asociadas a zonas de fluido persistente o a resolución reciente del fluido)8 (Figura 8).

Figura 6. Caso de corioretinopatía serosa central cronificada con varias recidivas en el tiempo. Las imágenes hiperautofluorescentes con el moteado hiperautofluorescente suelen corresponder a zonas de fluido subretiniano persistente. Las zonas que se observan más oscuras, o hipoautofluorescentes, son zonas donde se ha producido daño en el EPR por la cronicidad del cuadro.

Figura 7. Ambos ojos del mismo paciente afecto de corioretinopatía serosa central crónica. En el ojo izquierdo (imagen de la derecha) se observan los característicos tractos hipoautofluorescentes descendentes, que indican larga cronicidad del cuadro.

Figura 8. Ambos ojos de un paciente afecto de coriorretinopatía serosa central crónica con recidivas habituales. Es frecuente encontrar un patrón mixto de zonas hipoautofluorescentes (zonas de daño irreversible del EPR) con zonas de moteado hiperautofluorescente (zonas de desprendimiento neurosensorial o de resolución reciente del fluido).
La hiperautofluorescencia progresiva traduce una dificultad también progresiva del EPR para eliminar los segmentos externos fagocitados, y este proceso, a su vez, es proporcional a la duración del cuadro. Así, cuanto más crónico es el desprendimiento, mayor es el grado de hiperautofluorescencia. Spaide y Klancnik6 observaron que estas zonas de mayor hiperautofluorescencia se correspondían con áreas de acúmulo de material en la superficie externa de la retina en la OCT. Matsumoto et al.5 demostraron, en un estudio posterior, que lo que se creía que eran depósitos subretinianos se correspondían en realidad con los segmentos externos elongados de los fotorreceptores5.
Tanto la presencia de fluido crónico como la presencia de fluoróforos en el espacio subretiniano pueden contribuir al daño progresivo de las células del EPR y de los fotorreceptores7,9.
Como ya se ha mencionado, existen varios patrones de hipoautofluorescencia que denotan el daño del EPR en los casos de CSC crónica. Aunque es una enfermedad heterogénea y existe gran variedad de fenotipos clínicos, se ha propuesto una clasificación que divide los casos en tres grupos: hipoautofluorescencia granular, hipoautofluorescencia confluente y tractos descendentes hipoautofluorescentes8 (Figura 9). Como parece lógico, los estudios de correlación entre autofluorescencia y OCT demuestran que las áreas de hipoautofluorescencia se corresponden con zonas de atrofia del EPR y de la retina externa en la OCT6 (Figura 10).

Figura 9. Patrones típicos de hipoautofluorescencia en la coriorretinopatía serosa central crónica. A) Patrón hipoautofluorescente moteado con alguna placa confluente de hipoautofluorescencia central. B) Placas de hipoautofluorescencia central, que traducen atrofia grave del EPR. C) Tractos descendentes hipoautofluorescentes. Estos tractos típicamente descienden desde la papila (como en la imagen), desde la mácula o desde ambas.
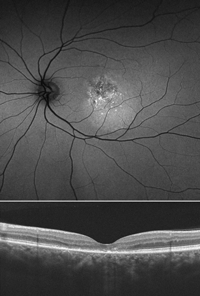
Figura 10. Correspondencia entre la hipoautofluorescencia moteada central (arriba) y las alteraciones puntuales en la línea de los elipsoides en la tomografía de coherencia óptica (abajo).
Pero la autofluorescencia no sólo permite reconocer la fisiopatología de la enfermedad y los cambios celulares, sino que también hace posible predecir en cierto grado el pronóstico visual final del paciente en función del patrón de autofluorescencia6,10,11. Así, el patrón de hipoautofluorescencia granular y confluente se correlaciona claramente con peores resultados visuales, mientras que la hiperautofluorescencia no parece correlacionarse de forma estadísticamente significativa con un pronóstico visual determinado8.
Otras modalidades de autofluorescencia en el estudio de la CSC
La autofluorescencia de longitud de onda corta convencional es la técnica que se usa habitualmente en la práctica clínica diaria, la que aporta las imágenes habituales como las que aquí se muestran. Existen nuevas técnicas que aprovechan la tecnología de la autofluorescencia para hacer estudios funcionales, como la densitometría retiniana, que es el único método objetivo para investigar los fotopigmentos retinianos en vivo12. Esta técnica, que puede realizarse mediante la propia autofluorescencia, permite valorar la densidad de fotopigmentos en el área a estudiar y su evolución en el tiempo13.Ojima et al.14 estudiaron casos de CSC con densitometría y encontraron una reducción de la densidad de fotopigmentos en el área de desprendimiento en las CSC agudas, siendo normal la retina circundante. Vieron también que, al resolverse el desprendimiento seroso, persistía la reducción de fotopigmentos en el área previamente afectada, y esto podía correlacionarse de manera adecuada con las alteraciones en la línea de los elipsoides observadas en la OCT. Con el tiempo se produce una recuperación progresiva de la densidad de fotopigmentos hasta valores previos. Esta recuperación lenta, posterior a la reabsorción del fluido, podría explicar los síntomas que presentan los pacientes (escotoma relativo, alteración en la visión de los colores, etc.) a pesar de la resolución del desprendimiento seroso14.
Como ya se ha mencionado, la autofluorescencia más utilizada en la práctica clínica es la luz azul de longitud de onda corta. Este tipo de luz estimula principalmente los fluoróforos contenidos en la lipofuscina y, por tanto, detecta la presencia o la ausencia de ésta en las células de la retina. En cambio, la autofluorescencia infrarroja estimula la melanina contenida en las capas del EPR y la coroides. La melanina tiene un efecto protector sobre los fotorreceptores y las células del EPR (por sus propiedades antioxidantes y su efecto fotoprotector), y por este motivo, medir las concentraciones de melanina en estos tejidos puede tener implicaciones clínicas, tanto diagnósticos como en el seguimiento15.
En los estudios realizados por Sekiryu et al.16 se encontró que pequeñas lesiones compatibles con acúmulos de células del EPR producían hiperautofluorescencia, tanto con autofluorescencia de onda corta como con autofluorescencia infrarroja. En cambio, algunas lesiones puntiformes hiperautofluorescentes con autofluorescencia de onda corta no lo eran con autofluorescencia infrarroja, lo cual podría deberse a una lesión más directa del fotorreceptor (que no contiene melanina, pero sí lipofuscina).
Estas nuevas modalidades diagnósticas están todavía en fases iniciales y es pronto para determinar sus implicaciones, aunque lo que sí parece cierto es que la combinación de ambas técnicas de forma simultánea podría aportar detalles anatómicos y celulares más precisos que cada una de ellas por separado.
Bibliografía
- Haimovici R, Koh S, Gagnon DR, Lehrfeld T, Wellik S. Risk factors for central serous chorioretinopathy: a case-control study. Ophthalmology. 2004;111(2):244-9.
- Baran NV, Gurlu VP, Esgin H. Long-term macular function in eyes with central serous chorioretinopathy. Clin Exp Ophthalmol. 2005;33(4):369-72.
- Kim SK, Kim SW, Oh J, Huh K. Near-infrared and short-wavelength autofluorescence in resolved central serous chorioretinopathy: association with outer retinal layer abnormalities. Am J Ophthalmol. 2013;156(1):157-64.e2.
- Nicholson B, Noble J, Forooghian F, Meyerle, C. Central serous chorioretinopathy: update on pathophysiology and treatment. Surv Ophthalmol. 2013;58(2):103-26.
- Matsumoto H, Kishi S, Sato T, Mukai R. Fundus autofluorescence of elongated photoreceptor outer segments in central serous chorioretinopathy. Am J Ophthalmol. 2011;151:617e1-623e1.
- Spaide RF, Klancnik JM Jr. Fundus autofluorescence and central serous chorioretinopathy. Ophthalmology. 2005;112:825-33.
- Maruko I, Iida T, Ojima A, Sekiryu T. Subretinal dot-like precipitates and yellow material in central serous chorioretinopathy. Retina. 2011;31:759-65.
- Imamura Y, Fujiwara T, Spaide RF. Fundus autofluorescence and visual acuity in central serous chorioretinopathy. Ophthalmology. 2011;118:700-5.
- Kim SR, Nakanishi K, Itagaki Y, Sparrow JR. Photooxidation of A2-PE, a photoreceptor outer segment fluorophore, and protection by lutein and zeaxanthin. Exp Eye Res. 2006;82 828-39.
- Oh J, Kim SW, Kwon SS, Oh IK, Huh K. Correlation of fundus autofluorescence gray values with vision and microperimetry in resolved central serous chorioretinopathy. Inv Ophthalmol Vis Sci. 2012;53(1):179-84.
- Özmert E, Batioglu F. Fundus autofluorescence before and after photodynamic therapy for chronic central serous chorioretinopathy. Ophthalmologica. 2009;223(4):263-8.
- Theelen T, Berendschot TT, Boon CJ, Hoyng CB, Klevering BJ. Analysis of visual pigment by fundus autofluorescence. Exp Eye Res. 2008;86(2):296-304.
- Sekiryu T, Iida T, Maruko I, Horiguchi M. Clinical application of autofluorescence densitometry using a scanning laser ophthalmoscope. Invest Ophthalmol Vis Sci. 2009;50(6):2994-3002.
- Ojima A, Iida T, Sekiryu T, Maruko I, Sugano Y. Photopigments in central serous chorioretinopathy. Am J Ophthalmol. 2011;151(6):940-52.e1.
- Roisman L, Lavinsky D, Magalhaes F, et al. Fundus autofluorescence and spectral domain OCT in central serous chorioretinopathy. J Ophthalmol. 2011;2011:706-849.
- Sekiryu T, Iida T, Maruko I, Saito K, Kondo T. Infrared fundus autofluorescence and central serous chorioretinopathy. Invest Ophthalmol Vis Sci. 2010;51:4956-62.