Volumen 22 - Número 5 - Diciembre 2014
Autofluorescencia en la degeneración macular asociada a la edad
MJ. Capella Elizalde, S. Abengoechea Hernández, S. Viver Oller
Unidad de Vítreo-Retina. Centro de Oftalmología Barraquer. Barcelona.
CORRESPONDENCIA
Mª José Capella Elizalde
E-mail: mjcapella@barraquer.com
E-mail: mjcapella@barraquer.com
Introducción
La autofluorescencia es una propiedad intrínseca de ciertas moléculas (denominadas fluoróforos) que consiste en la emisión transitoria de luz cuando éstas son estimuladas por una fuente exógena. En el fondo del ojo, la autofluorescencia deriva fundamentalmente de la lipofuscina presente en el epitelio pigmentado de la retina (EPR), la cual se origina de una degradación incompleta de los segmentos externos de los fotorreceptores y constituiría, por tanto, un claro marcador de la degeneración del EPR1.Existe un interés creciente por las pruebas complementarias no invasivas para el estudio de la patología retiniana. La obtención de imágenes in vivo de autofluorescencia como un índice de acúmulo de lipofuscina, y para visualizar y evaluar el estado metabólico y funcional del EPR, puede proporcionar datos importantes sobre la fisiopatogenia y la evolución de un gran número de patologías, entre las que destaca la degeneración macular asociada a la edad (DMAE), al ofrecer información que no se obtiene con la oftalmoscopia estándar ni la angiografía fluoresceínica (AGF), y de una forma rápida, no invasiva y muy poco costosa2,3.
Autofluorescencia y DMAE
El EPR desempeña un papel importante en la patogénesis de la DMAE, y la evidencia acumulada hasta la fecha indica la implicación de la lipofuscina en la disfunción y la pérdida de las células de dicha capa. Los gránulos de lipofuscina se acumulan en el EPR con la edad, y se ha propuesto que niveles excesivos pueden comprometer sus funciones esenciales4,5. Aunque es cierto que existe una asociación entre el acúmulo de lipofuscina y la patología del EPR, no existe todavía evidencia firme de que esta sustancia sea la causa directa de la disfunción celular, pues podría ser, a la inversa, que el acúmulo excesivo de lipofuscina fuera simplemente la expresión de una disfunción celular preexistente1.Las imágenes de autofluorescencia retiniana como un indicador de la distribución de la lipofuscina pueden ser útiles para profundizar en el conocimiento de la fisiopatogenia de la DMAE, identificar factores pronósticos, estimar el riesgo de progresión de la enfermedad y valorar la utilidad o no de una posible intervención terapéutica.
Los estadios iniciales de la DMAE están caracterizados por la presencia de drusas y lesiones de hiperpigmentación y/o hipopigmentación en el área macular. Las drusas son depósitos extracelulares localizados entre el EPR y la membrana de Bruch, y contienen lípidos, proteínas de matriz y componentes de origen inflamatorio.
La autofluorescencia en los pacientes en estadios iniciales de DMAE puede mostrar alteraciones que se detectan antes que con cualquier otra prueba complementaria, incluso antes que en el examen biomicroscópico. Así pues, es una prueba con una alta sensibilidad para este tipo de lesiones.
Las lesiones hipopigmentadas puntiformes darán lugar a una baja señal de autofluorescencia debido a la ausencia de lipofuscina en dicha zona, ya que existe una atrofia del EPR. En cambio, las lesiones hiperpigmentadas puntiformes generan imágenes de hiperautofluorescencia debido a que contienen melanolipofuscina.
En 2005, el Fundus Autofluorescence Study Group definió ocho patrones diferentes de autofluorescencia en las fases iniciales de la DMAE6:
- Patrón normal: hipoautofluorescencia central con autofluorescencia homogénea a su alrededor.
- Patrón de mínimos cambios: pocas drusas duras asociadas con alteraciones pigmentadas, dando lugar a una autofluorescencia irregular.
- Patrón con incremento focal: caracterizado por la presencia de como mínimo una alteración hiperautofluorescente que mida hasta 200 µm de diámetro.
- Patrón parcheado: caracterizado por la presencia de como mínimo un área de hiperautofluorescencia que mida más de 200 µm y con un aumento de la autofluorescencia relativa a su alrededor.
- Patrón lineal: debe presentar como mínimo una línea de hiperautofluorescencia. Suele corresponder a zonas hiperpigmentadas lineales.
- Patrón en forma de cordón: contiene múltiples bandas hiperautofluorescentes.
- Patrón reticular: presencia de múltiples puntos hipoautofluorescentes menores de 200 µm asociados a un aumento de la autofluorescencia alrededor de la mácula. Suelen corresponder a drusas reticulares.
- Patrón moteado: contiene múltiples alteraciones autofluorescentes que se extienden hasta las arcadas vasculares. Generalmente se aprecian alteraciones pigmentadas y drusas confluentes.
Drusas de la membrana de Bruch
La señal de autofluorescencia de las drusas individuales puede estar aumentada, disminuida o normal respecto a la autofluorescencia de base. La heterogeneidad tanto en la composición como en la alteración del EPR suprayacente puede ser la causa de este fenómeno. Según Solbach et al.7, el EPR suprayacente a las áreas con drusas blandas muestra una degeneración acompañada por una reducción de la densidad celular. Por lo tanto, los niveles de lipofuscina deberían estar disminuidos en dichas áreas y se postula que la isoautofluorescencia o la hiperautofluorescencia podrían deberse a la presencia de otros materiales fluorescentes.Lois et al.8 no hallaron una buena correspondencia entre la distribución de las drusas y la autofluorescencia, a pesar de que se cree que el material depositado en la membrana de Bruch para formar las drusas deriva del EPR. La única excepción a este hallazgo fueron las drusas blandas foveales grandes, que parecen corresponder de forma constante a áreas de hiperautofluorescencia, cuyo origen se desconoce.
Por otro lado, Delori et al.9 hallaron un patrón de autofluorescencia frecuentemente asociado con las drusas blandas y duras, que consiste en un centro hipoautofluorescente rodeado, en algunos casos, de un anillo de hiperautofluorescencia (patrón que no había sido publicado previamente). El tamaño del anillo encaja con la dimensión externa de la drusa. Aunque la mayoría de las drusas individuales se asociaba con este patrón, no todos los focos de hipoautofluorescencia estaban asociados con drusas. La hipoautofluorescencia no se debía a pigmento melánico en el EPR suprayacente, ya que las imágenes monocromáticas no mostraban evidencia de absorción de melanina. Así pues, como posibles explicaciones a este patrón de autofluorescencia, Delori et al.9 sostienen que el EPR tensionado sobre las drusas puede contener una capa mucho más fina de lipofuscina y, por lo tanto, mostrar dicha hipoautofluorescencia, o bien que las drusas hacen que el EPR suprayacente libere gránulos de lipofuscina que son fagocitados por el propio EPR en la periferia de la drusa, creando este patrón en anillo (Figura 1).
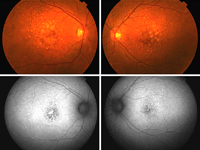
Figura 1. Drusas blandas confluentes en el polo posterior que se traducen en una hipoautofluorescencia central rodeada de un anillo hiperautofluorescente.
La regresión de las drusas en las fases intermedias de la DMAE es una constante. Toy et al.10 evidenciaron que alrededor del 50% de los pacientes con una media de seguimiento de 2 años presentaron zonas de regresión. En la mayoría de los casos (65%) se hallaron alteraciones en forma de hipoautofluorescencia en dichas zonas, lo que representa una asociación directa con cambios estructurales de la retina externa en este proceso.
Finalmente, la hiperpigmentación focal o lineal presente en los ojos con drusas suele asociarse a hiperautofluorescencia, probablemente derivada de la presencia de melanolipofuscina11.
Atrofia geográfica
Las áreas de atrofia geográfica de la DMAE se muestran como zonas de marcada hipoautofluorescencia (Figura 2), debido a la ausencia de células del EPR y, por tanto, de material autofluorescente a este nivel, lo que permite delimitar de forma precisa las zonas atróficas y su progresión con el tiempo. Estas áreas atróficas están rodeadas por diferentes patrones de autofluorescencia anormal, con gran variabilidad interindividual y con probable impacto en la progresión de la enfermedad (Figura 3).

Figura 2. Atrofia geográfica. Marcada hipoautofluorescencia secundaria a una completa atrofia de las células del epitelio pigmentado macular con compromiso foveal.

Figura 3. DMAE de tipo atrófico. Las áreas de atrofia geográfica se muestran como zonas bien delimitadas de hipoautofluorescencia, rodeadas por diferentes patrones de autofluorescencia anormal, predominantemente con un moteado hiperautofluorescente.
Holz et al.12 publicaron una serie corta de tres pacientes y sugieren que las áreas de hiperautofluorescencia (y por tanto el acúmulo excesivo de lipofuscina) en el polo posterior y rodeando las áreas de atrofia geográfica pueden preceder al desarrollo y la progresión de dicha atrofia. Observaron que en los sucesivos controles posteriores se desarrollaban nuevas áreas atróficas y aumentaba el tamaño de las preexistentes en las zonas previamente hiperautofluorescentes, fenómeno que no se observaba en áreas con una autofluorescencia previa normal. Por lo tanto, estas áreas de hiperautofluorescencia representarían áreas de EPR con una función anormal y vulnerables al cambio atrófico subsiguiente. Tales observaciones indican que el acúmulo excesivo de lipofuscina puede ser de gran importancia para la patogénesis de la atrofia geográfica asociada a la DMAE. Por ello, Holz et al.12 establecen que las imágenes de autofluorescencia en el seguimiento de los pacientes con DMAE podrían permitir la identificación de factores pronósticos (detección de áreas de atrofia incipiente) y proporcionar claves importantes para la comprensión de los mecanismos fisiopatogénicos de la enfermedad.
Si un aumento del contenido de lipofuscina precede a la muerte celular, podría especularse que la diseminación del área atrófica sería mayor y más rápida hacia áreas con hiperautofluorescencia más intensa. Basándose en esto, el mismo grupo de autores13 demostró años más tarde una correlación significativa entre la extensión de la hiperautofluorescencia rodeando las zonas atróficas y la tasa de progresión de dicha atrofia, por lo que, de igual modo, remarcaron la importancia de la autofluorescencia como una herramienta útil para identificar factores pronósticos y características de alto riesgo en los pacientes con DMAE atrófica avanzada. Sin embargo, contrariamente a lo que opinan dichos autores, Hwang et al.14 no hallaron ninguna asociación entre los patrones de autofluorescencia anormales y el desarrollo o la progresión de la atrofia geográfica. Sugieren que, aunque las áreas de hiperautofluorescencia pueden tener un valor predictivo positivo o negativo débil, los valores predictivos relativos no son mayores que el azar, por lo que debe existir un subgrupo de pacientes con atrofia geográfica en quienes la hiperautofluorescencia es altamente predictiva, pero en la mayoría de los pacientes esta no constituye un factor de riesgo. Debemos destacar que este último se trataba de un estudio con un escaso tamaño muestral (ocho ojos) y con un protocolo de adquisición de las imágenes distinto que sólo permitía una calidad moderada de estas.
Holz et al.15 identificaron varios patrones distintos de hiperautofluorescencia en el margen de la atrofia geográfica y realizaron una clasificación morfológica de ellos. Así demostraron que estos patrones tienen un impacto mucho mayor en la progresión de la atrofia que cualquier otro factor de riesgo analizado en estudios previos (Tabla 1). Observaron que el patrón difuso de trickling (cuya traducción literal es goteo y lo describen como una intensa hiperautofluorescencia en el margen de la atrofia, filtrándose hacia la periferia) se asocia con un aumento de la atrofia significativamente mayor en comparación con los otros patrones difusos. Recientemente se ha descrito que los pacientes que presentan el patrón difuso trickling son más jóvenes y tienen más alteraciones cardiovasculares que aquellos que presentan otro patrón de crecimiento de la atrofia geográfica16. Otros estudios, como el realizado por Jeong et al.17, confirman que los patrones de autofluorescencia son un valor predictivo fiable para el crecimiento de la atrofia geográfica con el tiempo. El segundo patrón de crecimiento más rápido tras el difuso es el patrón en banda.

Tabla 1. Patrones de autofluorescencia en la DMAE atrófica.
Actualmente existen diferentes sistemas informáticos que permiten cuantificar el tamaño y el grado de avance de la atrofia geográfica con una alta concordancia interobservadores e intraobservador18.
Neovascularización coroidea y desprendimiento del epitelio pigmentado
Existe un menor interés respecto a los hallazgos de autofluorescencia en ojos con neovascularización coroidea (NVC) asociada a DMAE, ya que la lesión principal no reside en el EPR. Dandekar et al.19 y Vaclavik et al.20 evaluaron las imágenes de autofluorescencia en diferentes estadios de NVC. En las NVC de inicio reciente observaron una autofluorescencia preservada, lo que indica una viabilidad del EPR conservada inicialmente que puede tener importantes implicaciones para el pronóstico visual a largo plazo y para posibles intervenciones terapéuticas (Figura 4). En cambio, en estadios más avanzados (entre 1 y 6 meses desde el diagnóstico y en cicatrices disciformes) observaron zonas de hipoautofluorescencia por pérdida del EPR y de fotorreceptores (Figura 5). Según estos autores, existe evidencia de una asociación entre los hallazgos de autofluorescencia, el tamaño de la lesión y la agudeza visual (la cual era mejor en los pacientes con autofluorescencia macular intacta). Por el contrario, no hallaron correlación entre la integridad de la autofluorescencia y el tipo de NVC20.
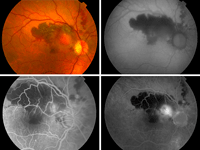
Figura 4. DMAE con membrana neovascular subretiniana activa y hemorragia secundaria. En la imagen de autofluorescencia (arriba a la derecha) se observa una hipoautofluorescencia bien delimitada correspondiente a la hemorragia subretiniana, por bloqueo de la autofluorescencia de base del EPR subyacente. En esta misma imagen, a nivel de la membrana neovascular se observa una isoautofluorescencia, probablemente relacionada con el inicio reciente de la lesión. Las imágenes inferiores muestran el comportamiento angiográfico de dicha neovascularización coroidea.

Figura 5. DMAE con fibrosis subfoveal y atrofia extensa del EPR. En la imagen de autofluorescencia observamos que tanto la atrofia del EPR como la fibrosis subretiniana aparecen hipoautofluorescentes, debido a la pérdida del EPR y de los fotorreceptores a ese nivel por el avanzado estadio de la enfermedad.
Tanto en los estadios iniciales como en los avanzados, la existencia de hemorragia subretiniana o exudados intraretinianos se correspondía con áreas de hipoautofluorescencia, debido a un bloqueo de la autofluorescencia de base del EPR (Figura 4). En los dos casos con DEP avascular hallaron una intensidad de autofluorescencia normal del EPR sobre él, lo que coincide con la idea de que estas lesiones ocurren debido a cambios en la estructura de la membrana de Bruch, y que la anatomía y la función del EPR suprayacente podría permanecer inalterada.
En los casos de DEP avascular que nosotros hemos estudiado llama la atención la hiperautofluorescencia lineal que aparece en el contorno del DEP, y que parece coincidir con el ángulo que forma el DEP con el EPR aplicado (Figura 6 y Figura 7)21. Las imágenes de autofluorescencia, a diferencia de otras técnicas, permiten examinar selectivamente el EPR y proporcionan más información que la AGF por sí sola acerca de la integridad de dicha capa.

Figura 6. DEP no vascularizado. La tomografía de coherencia óptica confirma el diagnóstico y demuestra la presencia de fluido subretiniano plano asociado. En la imagen autofluorescente se observa el DEP hipoautofluorescente con estrías hiperautofluorescentes que podrían corresponder a depósitos de melanolipofuscina, y el contorno del DEP se muestra hiperautofluorescente.

Figura 7. DEP avascular. Se aprecia claramente el límite en la autofluorescencia mediante una línea hipoautofluorescente asociada a una banda hiperautofluorescente.
McBain et al.22 analizaron las imágenes de autofluorescencia en 43 ojos con NVC recién diagnosticada, puramente clásica u oculta. En los ojos con NVC puramente clásica hallaron un patrón de autofluorescencia característico: un área de hipoautofluorescencia bien definida en el lugar de la NVC, probablemente relacionada con el bloqueo de la autofluorescencia causado por el crecimiento de la NVC en el espacio subretiniano, más que con una disfunción grave del EPR debida al proceso neovascular (la cual sería improbable por presentar todos los pacientes incluidos en su estudio una NVC recién diagnosticada). En algunos casos observaron un anillo de hiperautofluorescencia alrededor de la NVC que en la AGF correspondía a un área de bloqueo de la fluorescencia, por lo que podría tratarse probablemente de una proliferación de células del EPR alrededor de la membrana neovascular.
En las NVC ocultas existía un patrón de autofluorescencia más variable, en relación a la mayor heterogeneidad en la naturaleza de esta lesión, aunque con frecuencia observaron focos de hipoautofluorescencia que probablemente corresponden a pequeñas áreas de lesión o pérdida del EPR, ya que la mayoría de las NVC ocultas parecen crecer bajo el EPR y suelen presentar un curso más crónico e indolente que las clásicas.
Aunque, como ya se ha comentado, Dandekar et al.19 sugieren que la presencia de una autofluorescencia normal o casi normal en las áreas de NVC indica un EPR con viabilidad preservada y un mejor pronóstico, según los hallazgos de McBain et al.22 es difícil establecer si el EPR está sano o no sobre la NVC basándose únicamente en las imágenes de autofluorescencia, en especial si se observa hipoautofluorescencia.
Contrariamente a lo observado en ojos con DMAE atrófica, en las formas exudativas no suelen encontrarse áreas de hiperautofluorescencia (excepto un fino anillo alrededor de la membrana neovascular, antes citado) ni antes del desarrollo de la NVC. Por tanto, estos hallazgos indican que la lipofuscina del EPR, con su consecuente hiperautofluorescencia, aunque parece estar implicada en el desarrollo de atrofia geográfica puede no tener un papel importante en el desarrollo de NVC22.
En la Tabla 2 se muestra, a modo de resumen, la interpretación de las imágenes de autofluorescencia en los pacientes con DMAE.

Tabla 2. Características de la autofluorescencia de diversos signos clínicos de la DMAE.
Conclusiones
La autofluorescencia es, en la actualidad, una prueba muy útil para valorar el estado metabólico y funcional del EPR, pieza esencial en la evolución de la DMAE. Asimismo, es una herramienta altamente fiable para valorar el grado de avance de la atrofia geográfica en función del patrón que presente la lesión en sus márgenes.Es una prueba complementaria que aporta información que tanto la tomografía de coherencia óptica como la angiografía no pueden ofrecer, y por ello se considera esencial poder disponer de ella para realizar un seguimiento más preciso de la DMAE y establecer un pronóstico según sus patrones.
La autofluorescencia es una técnica de exploración emergente en la práctica diaria, con grandes expectativas de futuro y, a buen seguro, su uso se extenderá progresivamente a medida que se conozcan mejor su interpretación y sus verdaderas indicaciones.
Bibliografía
- Kennedy CJ, Rakoczy PE, Constable IJ. Lipofuscin of the retinal pigment epithelium: a review. Eye. 1995;9:763-71.
- Von Rückmann A, Fitzke FW, Bird AC. Distribution of fundus autofluorescence with a scanning laser ophthalmoscope. Br J Ophthalmol. 1995;79:407-12.
- Hopkins J, Walsh A, Chakravarthy U. Fundus autofluorescence in age-related macular degeneration: an epiphenomenon? Invest Ophthalmol Vis Sci. 2006;47:2269-71.
- Delori FC, Dorey CK, Staurenghi G, Arend O, Goger DG, Weiter JJ. In vivo fluorescence of the ocular fundus exhibits retinal pigment epithelium lipofuscin characteristics. Invest Ophthalmol Vis Sci. 1995;36:718-29.
- Delori FC, Goger DG, Dorey CK. Age-related accumulation and spatial distribution of lipofuscin in RPE of normal subjects. Invest Ophthalmol Vis Sci. 2001;42:1855-66.
- Bindewald A, Bird AC, Dandekar SS, et al. Classification of fundus autofluorescence patterns in early age-related macular disease. Invest Ophthalmol Vis Sci. 2005;46:3309-14.
- Solbach U, Keilhauer C, Knabben H, Wolf S. Imaging of retinal autofluorescence in patients with age-related macular degeneration. Retina. 1997;17:385-9.
- Lois N, Owens SL, Coco R, Hopkins J, Fitzke FW, Bird AC. Fundus autofluorescence in patients with age-related macular degeneration and high risk of visual loss. Am J Ophthalmol. 2002;133:341-9.
- Delori FC, Fleckner MR, Goger DG, Weiter JJ, Dorey CK. Autofluorescence distribution associated with drusen in age-related macular degeneration. Invest Ophthalmol Vis Sci. 2000;41:496-504.
- Toy BC, Krishnadev N, Indaram M, et al. Drusen regression is associated with local changes in fundus autofluorescence in intermediate age-related macular degeneration. Am J Ophthalmol. 2013;156:532-42.
- Von Rückmann A, Fitzke FW, Bird AC. Fundus autofluorescence in age-related macular disease imaged with a laser scanning ophthalmoscope. Invest Ophthalmol Vis Sci. 1997;38:478-86.
- Holz FG, Bellman C, Staudt S, Schutt F, Volcker HE. Fundus autofluorescence and development of geographic atrophy in age-related macular degeneration. Invest Ophthalmol Vis Sci. 2001;42:1051-6.
- Schmitz-Valckenberg S, Bindewald-Wittich A, Dolar-Szczasny J, Dreyhaupt J, Wolf S, Scholl HP, et al. Fundus Autofluorescence in Age-Related Macular Degeneration Study Group. Correlation between the area of increased autofluorescence surrounding geographic atrophy and disease progression in patients with AMD. Invest Ophthalmol Vis Sci. 2006;47:2648-54.
- Hwang JC, Chan JW, Chang S, Smith RT. Predictive value of fundus autofluorescence for development of geographic atrophy in age-related macular degeneration. Invest Ophthalmol Vis Sci. 2006;47:2655-61.
- Holz FG, Bindewald-Wittich A, Fleckenstein M, Dreyhaupt J, Scholl HP, Schmitz-Valckenberg S; FAM Study Group. Progression of geographic atrophy and impact of fundus autofluorescence patterns in age-related macular degeneration. Am J Ophthalmol. 2007;143:463-72.
- Fleckenstein M, Schmitz-Valckenberg S, Lindner M, et al. The “Diffuse-trickling” fundus autofluorescence phenotype in geographic atrophy. Invest Ophthalmol Vis Sci. 2014;55:2911-20.
- Jeong YJ, Hong IH, Chung JK, et al. Predictors for the progression of geographic atrophy in patients with age-related macular degeneration: fundus autofluorescence study with modified camera. Eye. 2014;28:209-18.
- Panthier C, Querques G, Puche N, et al. Evaluation of semiautomated measurement of geographic atrophy in age-related macular degeneration by fundus autofluorescence in clinical setting. Retina. 2014;34:576-82.
- Dandekar SS, Jenkins SA, Peto T, Scholl HP, Sehmi KS, Fitzke FW, et al. Autofluorescence imaging of choroidal neovascularization due to age-related macular degeneration. Arch Ophthalmol. 2005;123:1507-13.
- Vaclavik V, Vujosevic S, Dandekar SS, Bunce C, Peto T, Bird AC. Autofluorescence imaging in age-related macular degeneration complicated by choroidal neovascularization. Ophthalmology. 2008;115:342-6.
- Capella MJ, Elizalde J. Autofluorescencia y patología macular. An Inst Barraquer. 2008;37:35-73.
- McBain VA, Townend J, Lois N. Fundus autofluorescence in exudative age-related macular degeneration. Br J Ophthalmol. 2007;91:491-6.