Volumen 22 - Número 5 - Diciembre 2014
Angiografía fluoresceínica en la degeneración macular asociada a la edad
L. Arias Barquet
Jefe de Sección de Retina. Hospital Universitari de Bellvitge. L’Hospitalet de Llobregat. Barcelona.
Profesor Asociado de la Universidad de Barcelona.
Profesor Asociado de la Universidad de Barcelona.
CORRESPONDENCIA
Luis Arias Barquet
E-mail: luisarias@telefonica.net
E-mail: luisarias@telefonica.net
Introducción
La angiografía fluoresceínica (AGF) fue introducida en oftalmología por Novotny y Alvis en 1961. Inicialmente se usó para el estudio de pacientes con retinopatía diabética e hipertensiva, y posteriormente se utilizó en la degeneración macular asociada a la edad (DMAE)1.La AGF en la DMAE resulta útil en la forma exudativa o neovascular de la enfermedad para clasificar la neovascularización coroidea (NVC) en función de su composición, tamaño y localización.
La fluoresceína sódica es una molécula de pequeño tamaño, con un peso molecular de 376,27 Da, altamente soluble en agua. Es estimulada por la luz en la franja de 465 a 490 nm, entrando en un estado de más energía. La molécula emite fluorescencia de mayor longitud de onda, entre 520 y 530 nm, decayendo a un estado de menor energía. En la clínica se utilizan dos filtros, uno excitador y otro de barrera. El filtro excitador permite el paso de luz azul que estimula la fluoresceína del ojo, que a su vez emite luz verde-amarilla. Asimismo, el filtro de barrera bloquea la luz azul reflejada y permite sólo el paso de luz verde-amarilla. La fluorescencia resultante es recogida por una cámara como una imagen2.
En condiciones normales, la fluoresceína sódica difunde a través de los vasos fenestrados de la coriocapilar, pero no atraviesa las barreras hematoretinianas. Por lo tanto, cualquier disfunción que dañe estas barreras, obstruya el flujo sanguíneo o cambie la pigmentación normal del epitelio pigmentario de la retina (EPR) puede provocar alteraciones en la AGF.
La fluoresceína sódica se elimina por vía renal tras su inyección intravenosa. En general, la AGF es un procedimiento seguro y las reacciones adversas graves son raras. Sin embargo, conviene informar al paciente de los posibles riesgos asociados a la prueba3.
Interpretación
En los pacientes con DMAE pueden observarse diversos patrones angiográficos, que pueden clasificarse en los que cursan con hipofluorescencia o hiperfluorescencia. La hipofluorescencia puede deberse a un bloqueo de la fluorescencia normal o a un defecto de llenado vascular (Tabla 1).

Tabla 1. Causas de hipofluorescencia.
La hiperfluorescencia puede deberse a una pérdida de la barrera normal a la fluorescencia coroidea de base, lo que se conoce como fluorescencia transmitida. La hiperfluorescencia también puede aparecer como resultado del acúmulo extravascular de colorante, o de la fuga o la exudación de vasos anómalos (Tabla 2)4. Por convención, la fuga de colorante dentro de un espacio anatómico se denomina “almacenamiento”, mientras que la fuga en un tejido se denomina “tinción”5.

Tabla 2. Causas de hiperfluorescencia.
Patrones angiográficos en la DMAE
Drusas y alteraciones del epitelio pigmentario
La mayoría de los pacientes con DMAE tienen drusas y alteraciones del EPR sin pérdida visual asociada. La AGF no estaría indicada en estos casos a no ser que se sospeche la presencia de NVC concomitante.Pueden identificarse diversos tipos de drusas. Las drusas duras son pequeñas (<63 µm), redondeadas, bien definidas y de coloración amarillenta, y corresponden a depósitos de material hialino en la membrana de Bruch. Angiográficamente se muestran hiperfluorescentes por un defecto de transmisión secundario al adelgazamiento del EPR suprayacente6. En ocasiones se observa una miríada de pequeñas drusas, denominadas cuticulares o drusas laminares basales, que adoptan un patrón angiográfico de “cielo estrellado” (Figura 1). Las drusas blandas son de mayor tamaño (>125 µm), blanquecinas, de límites mal definidos y con tendencia a confluir. El patrón angiográfico que pueden adoptar depende del grado de adelgazamiento del EPR suprayacente, de la composición histoquímica y de la edad del paciente. De este modo, en los pacientes más jóvenes y con predominio de depósitos fosfolípidos son hiperfluorescentes (Figura 2)7. Las drusas blandas representan desprendimientos localizados del EPR. La confluencia de drusas blandas puede producir un desprendimiento drusenoide del EPR, que muestra hiperfluorescencia y almacenamiento de colorante sin fuga más allá de los márgenes con áreas de hiperpigmentación focal (Figura 3).
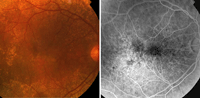
Figura 1. Drusas cuticulares (retinografía y angiografía fluoresceínica).
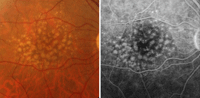
Figura 2. Drusas blandas (retinografía y angiografía fluoresceínica).

Figura 3. Desprendimiento drusenoide del epitelio pigmentario de la retina (retinografía y angiografía fluoresceínica).
Aparte de drusas es frecuente hallar alteraciones pigmentarias del EPR. La presencia de hiperpigmentación focal se considera un factor de riesgo para el desarrollo de NVC, y en la AGF se observa como fluorescencia bloqueada (Figura 4). Histopatológicamente se caracteriza por hipertrofia focal del EPR y migración de pigmento en el espacio subretiniano con lipofuscina intracelular8.
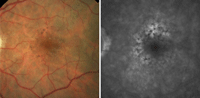
Figura 4. Alteraciones del epitelio pigmentario con hiperpigmentación focal (retinografía y angiografía fluoresceínica).
DMAE atrófica o seca
Se denomina atrofia geográfica (AG) cuando aparecen áreas bien definidas de atrofia grave. Asimismo, hay otra variante de DMAE seca caracterizada por zonas de atrofia menos definidas y de menor gravedad. Ambas variantes presentan pérdida del EPR, de manera más extensa y con atrofia concomitante de la retina y coriocapilar en la AG. En la AGF, la variante sin AG muestra hiperfluorescencia moteada precoz que no aumenta en las fases tardías, por efecto ventana (Figura 5).

Figura 5. DMAE seca sin atrofia geográfica (retinografía y angiografía fluoresceínica).
La AG típicamente muestra hiperfluorescencia tardía bien definida por tinción de la coroides expuesta y de la esclera9. En estos casos, la agudeza visual depende de la afectación foveal (Figura 6). En casos avanzados, los grandes vasos coroideos muestran un aspecto esclerótico (Figura 7).
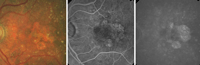
Figura 6. Atrofia geográfica (retinografía y angiografía fluoresceínica en fase precoz y tardía).

Figura 7. DMAE atrófica avanzada con aspecto esclerótico de los grandes vasos coroideos (retinografía y angiografía fluoresceínica).
Neovascularización coroidea clásica
La NVC clásica se caracteriza por una hiperfluorescencia bien delimitada en las fases iniciales de la AGF, con fuga o exudación en las fases tardías que desdibuja los márgenes de la lesión (Figura 8).

Figura 8. Neovascularización coroidea clásica (angiografía fluoresceínica en fase precoz y tardía).
La NVC clásica crece entre la retina neurosensorial y el EPR (NVC de tipo II)10. Dependiendo de su localización respecto a la fóvea, se clasifica en extrafoveal (>200 µm del centro foveal), yuxtafoveal (1-199 µm del centro foveal) o subfoveal (afectación del centro de la fóvea) (Figura 9). En muchos casos se aprecia un rodete hipofluorescente alrededor de la NVC clásica (Figura 10). Tampoco es infrecuente la presencia de sangre rodeando a la NVC clásica (Figura 11).

Figura 9. Angiografía fluoresceínica de neovascularización coroidea clásica extrafoveal (A), yuxtafoveal (B) y subfoveal (C).

Figura 10. Angiografía fluoresceínica (fase precoz y tardía) de neovascularización coroidea clásica con rodete hipofluorescente.

Figura 11. Angiografía fluoresceínica de neovascularización coroidea clásica con hemorragia circundante.
En los primeros años del siglo XXI las lesiones clásicas se trataban con terapia fotodinámica (TFD) con verteporfina, y se clasificaban, en función del porcentaje de NVC clásica, en predominantemente clásicas (>50% del total de la lesión) y mínimamente clásicas (<50% del total de la lesión) (Figura 12). La TFD era más eficaz en las lesiones predominantemente clásicas11. Hoy en día esta clasificación ha perdido vigencia, dado que el porcentaje de NVC clásica no parece ser un factor clave en la respuesta a la terapia antiangiogénica intravítrea.

Figura 12. Angiografía fluoresceínica de neovascularización coroidea predominantemente clásica (A) y mínimamente clásica (B).
Neovascularización coroidea oculta
La NVC oculta crece por debajo del EPR (NVC de tipo I) y se clasifica en desprendimiento del EPR (DEP) fibrovascular o exudación tardía de origen indeterminado12.El DEP fibrovascular, o NVC oculta de tipo I, se define como una elevación irregular del EPR asociada a hiperfluorescencia moteada visible 1 o 2 minutos después de la inyección intravenosa de fluoresceína con una exudación débil en las fases tardías de la AGF (Figura 13). Se diferencia de la NVC clásica en que la hiperfluorescencia precoz no es tan intensa y los márgenes de la lesión no están tan bien definidos.

Figura 13. Angiografía fluoresceínica de neovascularización coroidea oculta (desprendimiento fibrovascular del epitelio pigmentario).
La exudación tardía de origen indeterminado, o NVC oculta de tipo II, carece de una zona clara de exudación que pueda determinarse en las fases iniciales de la AGF, y en las fases tardías se observa una hiperfluorescencia moteada (Figura 14).

Figura 14. Angiografía fluoresceínica de neovascularización coroidea oculta (exudación tardía de origen indeterminado).
Desprendimiento seroso del epitelio pigmentario
Aunque el DEP seroso puede aparecer fuera del contexto de una DMAE, en la mayoría de las ocasiones guarda relación con la presencia de una NVC. Angiográficamente se caracteriza por una hiperfluorescencia progresiva y uniforme desde las fases iniciales, con intenso almacenamiento de fluoresceína en las fases tardías (Figura 15). La asociación de NVC oculta y DEP seroso se denomina DEP vascularizado13,14. En ocasiones puede observarse un DEP seroso asociado a una NVC clásica (Figura 16).
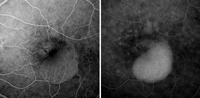
Figura 15. Angiografía fluoresceínica de neovascularización coroidea oculta asociada a desprendimiento seroso del epitelio pigmentario.

Figura 16. Angiografía fluoresceínica de neovascularización coroidea clásica asociada a desprendimiento seroso del epitelio pigmentario.
Proliferación angiomatosa de la retina
Las lesiones tipo proliferación angiomatosa de la retina (RAP) se consideran un subtipo de DMAE en el cual el estímulo neovascular es intraretiniano (NVC de tipo III)15. Se clasifican en tres estadios: I, caracterizado por neovascularización intraretiniana; II, con progresión a neovascularización subretiniana; y III, con progresión a NVC. A menudo son visibles anastomosis retinoretinianas y, en fases más avanzadas, anastomosis retinocoroideas.Angiográficamente, las lesiones tipo RAP en estadio I muestran un área focal de hiperfluorescencia de límites mal definidos, que corresponde a la neovascularización intraretiniana, rodeada de un halo de edema (Figura 17). A veces, estas lesiones RAP iniciales se confunden con una NVC clásica. En el estadio II, es patognomónico encontrar un DEP seroso asociado a edema macular quístico suprayacente (Figura 18). El estadio III con frecuencia es indistinguible de otro subtipo de DMAE, y el diagnóstico de RAP suele realizarse a partir de los hallazgos del ojo adelfo.

Figura 17. Angiografía fluoresceínica de proliferación angiomatosa de la retina (estadio I).

Figura 18. Angiografía fluoresceínica de proliferación angiomatosa de la retina (estadio II).
La angiografía con verde de indocianina en las lesiones tipo RAP típicamente muestra la presencia de puntos calientes, sobre los cuales se focalizaba el spot del láser cuando se aplicaba TFD. Actualmente, la tendencia más generalizada es tratar las lesiones tipo RAP con terapia antiangiogénica.
Vasculopatía coroidea polipoidea
En la vasculopatía coroidea polipoidea (VCP), la alteración inicial reside en la circulación coroidea, con la formación característica de pólipos. Clínicamente, la VCP cursa con desprendimientos recurrentes serohemorrágicos del EPR16.La angiografía con verde de indocianina es más útil que la AGF en estos casos, ya que permite delimitar los pólipos coroideos con mucha precisión (Figura 19).

Figura 19. Retinografía (A), angiografía fluoresceínica (B) y angiografía con verde de indocianina (C) de vasculopatía coroidea polipoidea.
La TFD es muy eficaz para producir el cierre de los pólipos, aunque suele combinarse con inyecciones intravítreas de fármacos antiangiogénicos para disminuir la exudación.
Desgarros del epitelio pigmentario
Aunque los desgarros o roturas del EPR pueden ocurrir espontáneamente, suelen producirse tras el tratamiento con TFD o terapia antiangiogénica. Las roturas del EPR son una complicación frecuente en el contexto de la DMAE exudativa que cursa con DEP, aunque también se han descrito en lesiones clásicas17.La monocapa del EPR desprendida se enrolla hacia la NVC, dejando una zona denudada con coroides expuesta. Angiográficamente, la zona denudada se muestra hiperfluorescente y el EPR enrollado aparece hipofluorescente (Figura 20).

Figura 20. Desgarro del epitelio pigmentario (retinografía y angiografía fluoresceínica).
DMAE hemorrágica
En las formas hemorrágicas de DMAE la AGF no suele ser muy útil, ya que la sangre bloquea la fluorescencia y no se aprecia la NVC (Figura 21).

Figura 21. DMAE hemorrágica (retinografía y angiografía fluoresceínica).
Cicatriz macular disciforme
Una cicatriz macular disciforme representa el estadio final de una DMAE neovascular. Angiográficamente muestra tinción en las fases tardías (Figura 22).

Figura 22. Cicatriz macular (retinografía y angiografía fluoresceínica).
Monitorización del tratamiento
En la era de la TFD con verteporfina, la AGF era la principal prueba complementaria para monitorizar la respuesta al tratamiento en los pacientes con DMAE exudativa18. Actualmente, con la terapia antiangiogénica, la OCT ha reemplazado a la AGF en el seguimiento de esta enfermedad19. No obstante, en algunos casos sigue siendo de utilidad para evaluar la necesidad de retratamiento.Bibliografía
- Novotny HR, Alvis DL. A method of photographing fluorescence in circulating blood in the human retina. Circulation. 1961;24:82-6.
- Wolfe DR. Fluorescein angiography: basic science and engineering. Ophthalmology. 1986;93:1617-20.
- Yannuzzi LA, Rohrer KT, Tindel LJ, et al. Fluorescein angiography complication survey. Ophthalmology. 1986;93:611-7.
- Jumper JM, Fu AD, McDonald HR, Johnson RN, Ai E. Fluorescein angiography. En: Alfaro DV, Liggett PE, Mieler WF, Quiroz-Mercado H, Jager RD, Tano Y, editores. Age-related macular degeneration. Philadelphia: Lippincott Williams & Wilkins; 2006. p. 86-100.
- Spaide RF. Fundus angiography. En: Holz FG, Pauleikhoff D, Spaide RF, Bird AC, editores. Age-related macular degeneration. Heidelberg: Springer; 2004. p. 87-107.
- Bressler NM, Bressler SB, Fine SL. Age-related macular degeneration. Surv Ophthalmol. 1988;32:375-413.
- Pauleikhoff D, Zuels S, Sheraidah GS, et al. Correlation between biochemical composition and fluorescein binding of deposits in Bruch’s membrane. Ophthalmology. 1992;99:1548-53.
- Spaide RF. Fundus autofluorescence and age-related macular degeneration. Ophthalmology. 2003;110:392-9.
- Pieramici DJ, Bressler SB. Fluorescein angiography. En: Berger JW, Fine SL, Maguire MG, editores. Age-related macular degeneration. St. Louis: Mosby. p. 219-36.
- Gass JDM. Pathogenesis of disciform detachment of the neuroepithelium. Am J Ophthalmol. 1967;63:567-659.
- Barbazetto I, Burdan A, Bressler NM, et al. Photodynamic therapy of subfoveal choroidal neovascularization with verteporfin: fluorescein angiographic guidelines for evaluation and treatment – TAP and VIP report No. 2. Arch Ophthalmol. 2003;121:1253-68.
- Macular Photocoagulation Study Group. Subfoveal neovascular lesions in age-related macular degeneration. Guidelines for evaluation and treatment in the macular photocoagulation study. Arch Ophthalmol. 1991;109:1242-57.
- Gass JDM. Serous retinal pigment detachment with a notch. Retina. 1984;4:205-20.
- Coscas G, Koenig F, Soubrane G. The pretear characteristics of pigment epithelial detachments. A study of 40 eyes. Arch Ophthalmol. 1990;108:1687-93.
- Yannuzzi LA, Negrao S, Iida T, et al. Retinal angiomatous proliferation in age-related macular degeneration. Retina. 2001;21:416-34.
- Yannuzzi LA, Sorenson J, Spaide RF, et al. Idiopathic polypoidal choroidal vasculopathy. Retina. 1990;10:1-8.
- Arias L, Caminal J, Rubio M, et al. Retinal pigment epithelial tears after intravitreal bevacizumab injection for predominantly classic choroidal neovascularization. Eur J Ophthalmol. 2007;17:992-5.
- Verteporfin Roundtable Participants. Guidelines for using verteporfin (Visudyne) in photodynamic therapy for choroidal neovascularization due to age-related macular degeneration and other causes: update. Retina. 2005;25:119-34.
- Fung AE, Lalwani GA, Rosenfeld PJ, et al. An optical coherence tomography-guided, variable dosing regimen with intravitreal ranibizumab (Lucentis) for neovascular age-related macular degeneration. Am J Ophthalmol. 2007;143:566-83.