Volumen 22 - Número 5 - Diciembre 2014
Angiografía de campo amplio en el diagnóstico, el tratamiento y el seguimiento de las oclusiones venosas retinianas
AR. Oleñik Memmel1, G. Arcos Algaba1, J. GarcÃa-ArumÃ2
1Especialista en Oftalmología. Máster Vítreo-Retina. IMO (Instituto de Microcirugía Ocular). Universidad Autónoma de Barcelona. Barcelona.
2IMO (Instituto de Microcirugía Ocular). Catedrático de Oftalmología. Universidad Autónoma de Barcelona. Jefe de Servicio. Hospital Universitari Vall d’Hebron. Barcelona.
CORRESPONDENCIA
José García-Arumí
E-mail: jgarcia.arumi@gmail.com
E-mail: jgarcia.arumi@gmail.com
Retinografía y angiografía de campo amplio
El retinógrafo de campo amplio Optomap 200 (Optos Panoramic Retinal Exam, Durfemline, Scotland, United Kingdom) es un láser confocal de espejos parabólicos diseñado para obtener una imagen única de la retina de 200°. Esta imagen puede ser captada en ausencia de midriasis y en un corto periodo de tiempo (0,25 s). A diferencia de los dispositivos convencionales, esta tecnología incorpora longitudes de onda láser de baja potencia que realizan el barrido simultáneamente, lo que permite la revisión de las subestructuras retinianas1:- El láser verde (532 nm) realiza el barrido desde la retina sensorial hasta la capa del epitelio pigmentario.
- El láser rojo (633 nm) realiza el barrido desde el epitelio pigmentario hasta la coroides (Figura 1).
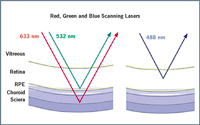
Figura 1. Imagen obtenida de Optos en la que se observa la diferencia en cuanto a la penetrancia del láser en el retinógrafo de campo amplio Optomap.
Otra característica a destacar es la ausencia de fotofobia en los pacientes tras el examen, ya que este aparato trabaja con luz infrarroja de espectro no invisible; sin embargo, en las fotos en color existe sobresaturación de rojo, amarillo y verde en comparación con las cámaras tradicionales, y estos detalles pueden manipularse digitalmente2.
Para obtener la angiografía con fluoresceína en esta cámara se ha agregado un láser azul, que actúa como excitante de la fluoresceína (488 nm), y un filtro de barrera de 500 nm que se utiliza para el registro de la fluoresceína.
Si se destaca una característica de esta cámara realizando la angiofluoresceingrafía es las magníficas imágenes que se obtienen de la retina periférica observando zonas de retina isquémica no valorables con cámaras convencionales (Figura 2 A y B), por lo que en la patología de vascularización retiniana, como las oclusiones venosas, es de extrema utilidad ya que la actitud terapéutica puede estar influenciada por la misma1.
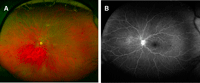
Figura 2. A) Retinografía de campo amplio de OVCR. B) Se observa isquemia en la extrema periferia.
Oclusiones venosas retinianas
Son una de las causas más frecuentes de enfermedad vascular retiniana. Su clasificación anatómica permite diferenciar en ellas diferentes evoluciones naturales, pronósticos y tratamientos3:- Oclusión de la vena central de la retina (OVCR): localizada en el nervio óptico (Figura 3).
-
Oclusión de la rama venosa retiniana (ORVR):
- ORVR mayor o principal: oclusión de primer orden fuera del nervio óptico, con afectación macular.
- ORVR macular o menor: afectación de rama macular.
- ORVR periférica: oclusión de rama venosa fuera del nervio óptico, sin afectación macular.
- Oclusión de vena hemiretiniana (oclusión de vena hemicentral, oclusión de vena hemisférica): dentro de las obstrucciones de vena retinianas podría definirse este grupo que reúne bajo un mismo nombre dos tipos de obstrucción venosa caracterizadas por un aspecto oftalmoscópico similar, apareciendo afectada una superficie aproximada de media retina, bien sea la superior o la inferior. De los tres tipos de obstrucción de vena, este parece ser el menos frecuente.

Figura 3. Imagen que muestra una típica angiofluoresceingrafía de campo amplio de una oclusión venosa central de tiempo de evolución. Se observan áreas de isquemia tanto en la media periferia como en la extrema periferia.
Fisiopatología4
- OVCR: variaciones anatómicas en la lámina cribosa provocan un síndrome compartimental. En este pequeño espacio coexisten la arteria central, la vena central de la retina y los axones del nervio óptico, por lo que cualquier cambio de estas estructuras provocaría un estrechamiento de la luz venosa con formación de flujo turbulento, daño endotelial y formación de un trombo.
- ORVR: las arterias y las venas en la retina comparten la adventicia. En los cruces arteriovenosos la arteria normalmente se ubica anterior a la vena, por lo que las alteraciones de la pared arterial, que suelen asociarse a hipertensión arterial y arterioesclerosis, provocarían un estrechamiento de la luz de la rama venosa y desencadenarían la misma cascada de sucesos antes descrita en la OVCR.
-
OHemi-R: en la patogenia de la obstrucción hemiretiniana pueden distinguirse dos tipos:
- Obstrucción venosa hemisférica (OVHF): la obstrucción se produce a nivel de un cruce arteriovenoso que interesa a una de las ramas principales de la vena central de la retina, que drena la mitad de la retina, distal a su división en temporal y nasal. Este cruce suele aparecer en la superficie o próximo al borde papilar.
- Obstrucción venosa hemicentral (OVHC): en un 20% a 25% de las personas, la vena central de la retina aparece todavía dividida en dos troncos a nivel de la zona anterior del nervio óptico, uniéndose distalmente. La obstrucción en este lugar se traduciría en una afectación hemiretiniana.
Factores de riesgo (Tabla 1)
Las oclusiones vasculares retinianas se asocian a mayor riesgo de muerte por causa vascular cardíaca o cerebral6, por lo que el oftalmólogo debe remitir o consultar al especialista adecuado para estudiar los factores de riesgo asociados. El inicio del manejo médico de los factores de riesgo debe realizarse dentro de los primeros 2 meses tras el diagnóstico8. No hay que olvidar la alta relación de la obstrucción venosa de rama retiniana con el glaucoma.

Tabla 1. Factores de riesgo5.
Los factores de riesgo parecen diferir según se trate de una obstrucción hemicentral o hemisférica; la obstrucción hemicentral aparece relacionada con hipertensión (48%), diabetes mellitus (44%) y glaucoma (44%), lo que la colocaría en la proximidad patogénica de la OVCR.
En todos los pacientes hay que realizar una valoración de la presión arterial, una analítica general (con pruebas de hemostasia), reactantes de fase aguda (velocidad de sedimentación globular y proteína C reactiva) y perfil lipídico.
Clínica
Las oclusiones venosas, tanto de la vena central como de la rama venosa retiniana, son más frecuentes en las personas mayores de 65 años y afectan por igual a hombres y mujeres7.Oclusión de la vena central de la retina
El motivo de consulta habitual es la pérdida visual unilateral e indolora (más llamativa en las formas isquémicas). La agudeza visual en el momento de la presentación es un importante indicador para el pronóstico de la agudeza visual final en estos casos.
Respecto al fondo de ojo, se aprecia dilatación y tortuosidad en todas las ramas de la vena central de la retina, con hemorragias retinianas superficiales (en llama) y profundas (en punto y mancha) en los cuatro cuadrantes de la retina. El edema macular, los exudados isquémicos (algodonosos) peripapilares y el edema de papila son hallazgos habituales (Figura 4 y Figura 5). Puede observarse un defecto pupilar aferente relativo (más frecuente en las formas isquémicas).

Figura 4. Retinografía de campo amplio de oclusión venosa central aguda y angiofluoresceingrafía.

Figura 5. Oclusión aguda de la vena central de la retina.
Otro signo valorable en la angiografía es la presencia de papiloflebitis asociada a la oclusión central venosa (Figura 6) y secuencia de angiografía de campo amplio, en la que puede observarse en tiempos precoces un vaso venoso central ocluido, en tiempos tardíos una importante área de isquemia temporal con vasculitis asociada y en el área central edema macular asociado.
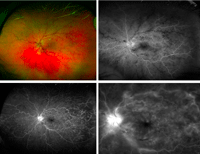
Figura 6. Se observa papiloflebitis asociada a oclusión venosa central y secuencia de angiografía de campo amplio en la que pueden verse isquemia periférica y edema macular.
Conforme evolucionan en el tiempo, los hallazgos oftalmoscópicos van cambiando, ya que las hemorragias se reabsorben (3 a 6 meses), se desarrollan vasos colaterales en la retina y en la papila (shunts optociliares), aparecen envainamiento y estrechamiento vascular, alteraciones maculares, y desaparece el edema de papila (Figura 7).
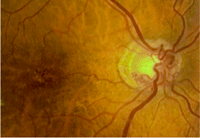
Figura 7. Oclusión de la vena central crónica. Se aprecian shunts optociliares en la papila y alteración del epitelio pigmentario macular.
Puede desarrollarse neovascularización retiniana (NVR) como principal complicación en el 15% al 34% de las formas no isquémicas y en el 50% de las isquémicas8.
Oclusión de la rama venosa de la retina
La presentación es muy variable, dependiendo de la cantidad de la red de drenaje macular afectada, con el consiguiente edema macular secundario, por lo que puede ir desde una pérdida brusca de visión unilateral hasta un defecto relativo al campo visual.
El origen de la obstrucción de rama venosa de la retina (idiopática) se localiza al en un cruce arteriovenoso en el que arteria y vena comparten una adventicia común. La arteriosclerosis arteriolar supone una comprensión a nivel de la vena que provoca alteraciones hemodinámicas distales, que pueden desembocar en una alteración endotelial y la posterior formación de un trombo.
En cuanto al fondo de ojo, se observa dilatación y tortuosidad venosa distal al punto de oclusión (cruce arteriovenoso) y atenuación vascular proximal. Están presentes hemorragias superficiales y profundas en el sector de drenaje afectado (Figura 8). También pueden encontrarse edema macular, dependiendo de si la obstrucción afecta al drenaje macular, y exudados isquémicos.

Figura 8. Obstrucción venosa retiniana superior asociada a edema macular e isquemia periférica.
Oclusión hemiretiniana8
Se destaca en esta forma de presentación el defecto campimétrico altitudinal (en las formas isquémicas), con pérdida brusca de visión indolora y no recuperable en la mayoría de los casos.
En la oftalmoscopia cabe distinguir un área de afectación retiniana de aproximadamente media retina, en general respetando el rafe horizontal, con engrosamiento y tortuosidad venosas, hemorragias retinianas y edema retiniano que suele afectar (en la mayoría de los casos) a la región macular.
También pueden encontrarse exudados algodonosos. El edema de papila suele ser sectorial, coincidiendo con la región retiniana afectada (fundamentalmente relacionada con casos de OVHC, aunque no siempre). Si se atiende a los dos tipos de OVH descritos, se debería poder distinguir aquellos cuyo origen se establece a partir de un cruce arteriovenoso (OVHF) de aquellos en que la obstrucción se origina en el interior de la porción anterior de un nervio óptico en el cual penetran dos troncos venosos separados. Lo cierto es que en ocasiones esta distinción es difícil, sobre todo en los estadios iniciales, cuando las abundantes hemorragias que acompañan a este tipo de obstrucción, junto con el edema retiniano y papilar, hacen difícil su determinación.
En casos ya evolucionados la clínica es mucho menos profusa, con desaparición gradual de las hemorragias (suelen persistir las localizadas en la periferia), del edema retiniano y del engrosamiento vascular. El desarrollo de circulación colateral suele seguir patrones distintos según el tipo de OVH.
Así, en el caso de la OVHC las colaterales se encuentran a nivel de la papila (entre la hemirretina superior e inferior y más raramente como shunts optociliares) y distales a los cruces arteriovenosos.
En la Figura 9 se observa la angiografía con fluoresceína de una oclusión de hemirretina venosa central inferior del ojo izquierdo.
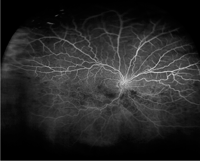
Figura 9. Angiografía con fluoresceína que muestra una oclusión de hemirretina venosa central inferior del ojo izquierdo.
Pruebas complementarias
Angiografía fluoresceínica de campo amplio1,2,9-11Es la prueba diagnóstica por excelencia (aunque en casos agudos y en presencia de múltiples hemorragias es difícil su valoración por el efecto pantalla de estas) y valora la perfusión retiniana.
Diferencia las formas isquémicas de las no isquémicas (de ahí la importancia del retinógrafo de campo amplio), que es uno de los principales factores pronósticos en esta patología. La angiografía de campo amplio permite evaluar toda la retina en el mismo tiempo angiográfico, la presencia de edema macular y la producción de factor de crecimiento endotelial vascular por isquemia en la extrema periferia y su resolución tras la aplicación de fotocoagulación periférica.
El estudio del área macular mediante magnificación puede ser de un aceptable detalle, pudiendo observar la zona avascular foveal y la presencia de edema macular.
La extensión de la perfusión periférica es sorprendentemente mucho mayor de lo esperado en muchos casos y no observado con las cámaras convencionales. En los pacientes tratados con fotocoagulación periférica se observan, en muchos casos, áreas de isquemia periférica no tratadas, aunque con menor detalle. Los neovasos en el disco óptico, la periferia y las arcadas son claramente detectables con una única imagen.
A diferencia de los sistemas clásicos, el seguimiento antes y después del tratamiento se simplifica y resulta más eficiente. Las zonas filtrantes maculares y las áreas de no perfusión periféricas son valoradas en una sola imagen (Figura 10).

Figura 10. Imagen de oclusión venosa temporal superior con área bien delimitada de isquemia valorada en una sola imagen.
El modo tridimensional (3D) funciona por mecanismos de láser confocal tomando varias imágenes seriadas de distinta profundidad. Forma parte del software incorporado al sistema y se basa en una reconstrucción de la imagen del fondo de ojo respetando la configuración anatómica. Puede utilizarse también como videosecuencia, en la cual el mismo sistema genera una animación rotatoria de perfil de 180° de movimiento.
Las ventajas del sistema de campo amplio (Figura 11) son:
- Puede utilizarse como método de cribado en pacientes sin dilatación.
- Es un procedimiento no invasivo.
- Su sistema de visualización permite, en una única toma, la observación de la mácula y la periferia, y ver toda la retina en el mismo tiempo angiográfico, por lo que resulta excelente para el seguimiento de la evolución tras el tratamiento.
- Detecta zonas de isquemia periférica no observada con cámaras convencionales. Es de gran utilidad para valorar la extensión de la isquemia.
- La sensibilidad en la zona anterior al ecuador es menor que en la posterior.
- Existe una saturación de los colores originales.
- Hay una disminución de calidad en la magnificación de los detalles (peor detalle macular).

Figura 11. Imagen que muestra una de las utilidades del sistema de campo amplio: se observa la importante isquemia en la periferia temporal superior asociada a trombosis de rama.
Oclusión de la vena central de la retina
La isquemia se define por la presencia de diez o más áreas de disco de no perfusión retiniana9. En la AGF se aprecia retraso del tiempo arteriovenoso, efecto pantalla por las hemorragias, edema macular variable e isquemia:
- OVCR no isquémica o edematosa: en el 75% de los casos. Tiene mejor pronóstico. Se aprecia buena perfusión capilar y edema macular variable (mayor complicación). Un tercio de estos casos evoluciona a isquemia.
- OVCR isquémica: en el 25% de los casos, de los cuales el 35% desarrollará neovascularización retiniana.
Oclusión de la rama venosa de la retina (Figura 12)
Se observan los mismos signos que en la OVCR, pero limitados solo al área de no perfusión. Si hay más de cinco áreas de disco de no perfusión se clasifica como isquémica y hay más riesgo de desarrollar neovascularización retiniana. La principal complicación es el edema macular, que depende de cuán afectada esté la circulación macular.

Figura 12. Imágenes que muestran trombosis de la vena retiniana superior; en la angiografía con fluoresceína se observan hemorragias retinianas, isquemia periférica y vasculitis asociada.
Oclusión hemivenosa retiniana
Con el estudio detallado de la papila y la distribución vascular puede determinarse, en un importante porcentaje de los casos, la localización de la obstrucción y así clasificar la obstrucción hemiretiniana en OVHC u OVHF.
La AFG ayuda en muchas ocasiones a determinar la localización de la obstrucción (y distinguir entre OVHC y OVHF). Así, habrá pacientes con áreas de isquemia variables, que permitirán clasificarlas en isquémicas o no isquémicas, aunque igual que en los otros tipos de obstrucción venosa existe un grupo de pacientes que desarrollan una progresiva oclusión del lecho capilar, lo que puede hacer que deban ser reclasificados de no isquémicos a isquémicos.
Tomografía de coherencia óptica
La OCT aporta información tanto cuantitativa como cualitativa del edema macular secundario, que se complementa con la información del estado de perfusión de la mácula que ofrece la AGF.
Pueden valorarse la morfología, el tipo de edema macular (Figura 13) y la respuesta al tratamiento mediante las variaciones en el espesor retiniano (valoración cuantitativa de la respuesta al tratamiento).

Figura 13. Edema macular quístico por oclusión de la rama venosa de la retina.
También es útil para la valoración de las complicaciones asociadas, como agujeros lamelares tras roturas de quistes, formación de membrana epiretiniana, presencia de agujero macular completo y síndrome de tracción vitreomacular.
Tratamiento12-14
No existe un tratamiento sistémico, preventivo ni curativo, para las oclusiones venosas. El papel de los anticoagulantes orales y de los antiagregantes es discutido y no altera la evolución natural de la enfermedad; por lo tanto, el tratamiento está principalmente orientado a las complicaciones oftalmológicas de las oclusiones, como son la NVR, glaucoma neovascular (GNV) y el edema macular (EM).El pronóstico visual final está muy ligado a la agudeza visual inicial.
Oclusión de la vena central de la retina
Neovascularización en la retina
Para orientar el tratamiento y el seguimiento primero hay que diferenciar entre las formas isquémicas y las no isquémicas mediante AGF. Si se determina una forma isquémica, se realiza un control estrecho cada 1 o 2 meses y se realiza una panretinofotocoagulación ante la presencia de NVR, neovascularización iridiana o GNV (Figura 14).

Figura 14. Oclusión isquémica de la vena central de la retina vista con panretinofotocoagulación con láser.
Edema macular
Es importante diferenciar el EM no isquémico del isquémico mediante AGF en cuanto la reabsorción de las hemorragias lo permita (3 a 6 meses).
Así como en el EMD, las opciones de tratamiento son similares, con algunos matices:
- La fotocoagulación en rejilla no produce ningún beneficio y no está indicada.
- Corticoides: implante de dexametasona intravítreo (Ozurdex®). Su efecto dura entre 3 y 4 meses aproximadamente, dependiendo de cada caso.
- Antiangiogénicos: ranibizumab (Lucentis®). La pauta de tratamiento es de dosis mensuales fijas hasta que se estabilice la agudeza visual. El aflibercept (Eylea®) ya tiene indicación terapéutica para la OVCR en Estados Unidos.
Oclusión de la rama venosa de la retina
Neovascularización en la retina
La NVR aparece cuando hay más de cinco áreas de disco de no perfusión (aproximadamente un cuadrante). Cuando aparece NVR está indicada la realización de fotocoagulación sectorial en la zona de isquemia retiniana13 (Figura 15).

Figura 15. Imágenes en las que pueden verse neovasos por encima del área de fotocoagulación, isquemia no tratada y hemorragia retrohialoidea (efecto pantalla en la angiografía con fluoresceína).
Edema macular
Se plantea el tratamiento cuando hay buena perfusión macular y agudeza visual menor o igual a 20/40. Tanto la fotocoagulación en rejilla, el ranibizumab (Lucentis®) como los implantes de dexametasona (Ozurdex®) se consideran un tratamiento de primera elección (Figura 16). Cuando la respuesta no es satisfactoria puede plantearse una combinación de ellos.

Figura 16. Implante de Ozurdex® en trombosis de rama venosa retiniana con edema macular secundario.
Tratamiento quirúrgico15,16
La cirugía solo se recomienda en algunos casos de hemorragia vítrea y GNV. Otras cirugías, como la neurotomía radial y la disección de la adventicia, únicamente se realizan en algunos casos concretos y de corta evolución, por lo que no se consideran opciones terapéuticas de primera elección.
Seguimiento
Para la OVCR no isquémica se realizarán controles mensuales los primeros 3 meses, y posteriormente cada 2 a 3 meses hasta completar 1 año. Deben realizarse controles periódicos los primeros 3 años por el riesgo de conversión a formas isquémicas. Los controles pueden variar según la agudeza visual inicial del paciente.
En la ORVR isquémica también se harán controles mensuales los primeros 3 meses, y luego cada 3 o 4 meses.
Los controles en los casos que presenten EM se realizarán de acuerdo con los tratamientos que se realicen:
- Fotocoagulación en rejilla: cada 3 meses. Este tratamiento solamente está comprobado que sea efectivo en el edema macular secundario a TVR, no en el secundario a TVCR, y actualmente está en desuso.
- Antiangiogénicos: controles mensuales con Lucentis® y bimensuales con Eylea®.
- Implantes de dexametasona: al primer mes y después cada 6 semanas.
Bibliografía
- Mackenzie PJ, Russell M, Ma PE, Isbister CM, Maberley DA. Sensitivity and specificity of the Optos Optomap for detecting peripheral retinal lesions. Retina. 2007;27(8):1119-24.
- Limitations of the panoramic Optomap 200 Jones Wl. Optom Vis Sci. 2004;81(3):165-6.
- Hayreh SS. Prevalent misconceptions about acute retinal vascular occlusive disorders. Prog Retin Eye Res. 2005;24:493-519.
- Hayre SS. Pathogenesis of occlusion of the central retinal vessels. Am J Ophthalmol. 1971;72:998-1011.
- Sociedad Española de Retina y Vítreo. Manual de retina de la SERV. Barcelona: Elsevier; 2013.
- García-Arumí J, Boixadera A, Martínez-Castillo V, Montolio M, Verdugo A, Corcóstegui B. Radial optic neurotomy in central retinal vein occlusion: comparison of outcome in younger vs older patients. Am J Ophthalmol. 2007;143(1):134-40.
- Sociedad Española de Retina y Vítreo. Guías de práctica clínica de la SERV. 2012.
- Hayreh SS, Hayreh MS. Hemi-central retinal vein occlusion. Pathogenesis, clinical features, and natural history. Arch Ophthalmol. 1980;98:1600-9.
- The Royal College of Ophthalmologists. Retinal vein occlusion (RVO) interim guidelines; 2009. Disponible en: http://www.rcophth.ac.uk
- Scott IU, Blodi BA, Ip MS, Vanveldhuisen PC, Oden NL, Chan CK, et al. SCORE Study Investigator Group. SCORE Study Report 2. Interobserver agreement between investigator and reading center classification of retinal vein occlusion type. Ophthalmology. 2009;116:756-61.
- Magargal LE, Donoso LA, Sanborn GE. Retinal ischemia and risk of neovascularization following central retinal vein obstruction. Ophthalmology. 1982;89:1241-5.
- Hayreh SS, Zimmerman MB, Podhajsky P. Incidence of various types of retinal vein occlusion and their recurrence and demographic characteristics. Am J Ophthalmol. 1994;117:429-41.
- The Central Vein Occlusion Study Group. Evaluation of grid pattern photocoagulation for macula edema in central vein occlusion. Ophthalmology. 1995;102:1425-33.
- Branch Vein Occlusion Study Group. Argon laser scatter photocoagulation for prevention of neovascularization and vitreous hemorrhage in branch vein occlusion. A randomized clinical trial. Arch Ophthalmol. 1986;104:34-41.
- García-Arumí J, Boixadera A, Martínez-Castillo V, Castillo R, Dou A, Corcóstegui B. Chorioretinal anastomosis after radial optic neurotomy for central vein oclussion. Arch Opththal. 2003;121:1385-91.
- García-Arumí J, Martínez-Castillo V, Boixadera A, Blasco H, Corcóstegui B. Management of macular edema in branch retinal vein oclussion with sheathotomy and recombinant tissue plasminogen activator. Retina. 2004;24:530-40.