Volumen 22 - N˙mero 5 - Diciembre 2014
Angiografía fluoresceínica en la retinopatía diabética
M. G├│mez-Resa, B. Corc├│stegui
Departamento de Retina y Vítreo. Instituto de Microcirugía Ocular (IMO). Barcelona.
CORRESPONDENCIA
María Gómez-Resa
E-mail: mariagomezresa@hotmail.com
E-mail: mariagomezresa@hotmail.com
La retinopatía diabética es la microangiopatía secundaria a la diabetes mellitus más frecuente. Es la principal causa de pérdida de visión entre los 30 y los 60 años de edad. Los principales factores de riesgo son la duración de la diabetes, la hiperglucemia, la hipertensión arterial, la nefropatía, la obesidad, las discrasias sanguíneas y la hiperlipidemia. Después de 20 años de evolución de la diabetes, aproximadamente el 90% de los pacientes tienen retinopatía.
El daño endotelial secundario a la hiperglucemia produce cierre capilar e isquemia de la retina. La hipoxia favorece el aumento de la concentración vítrea de factores angiogénicos (vascular endotelial growth factor, VEGF, o insulin-like growth factor 1, IGF1, entre otros) que van a intervenir en el aumento de la permeabilidad vascular y en el desarrollo de la neovascularización secundaria a la isquemia en fases más avanzadas.
La angiografía fluoresceínica (AFG) es la prueba por excelencia para el estudio de la barrera hematona y de la vascularización na y coroidea, siendo una técnica diagnóstica valiosa en la patología vascular de la retina. En condiciones normales, la fluoresceína sódica no es capaz de atravesar la pared de los capilares de la retina, ya que las uniones endoteliales no permiten su paso. Sin embargo, en la microangiopatía diabética los capilares se encuentran afectados, haciéndose permeables al paso del colorante, al igual que ocurre con los neovasos, que carecen de uniones endoteliales.
Las causas de pérdida de visión asociadas a la retinopatía diabética pueden deberse tanto a la acumulación de fluido en la mácula (edema macular) como a la isquemia macular secundaria a la oclusión capilar. Ambas circunstancias son fácilmente evaluables por medio de la AFG (Figura 1).
La AFG es una prueba importante en la detección temprana de las complicaciones de la retinopatía diabética, pudiendo actuar a tiempo para disminuir la incidencia de alteraciones visuales irreversibles. Por otra parte, la AFG es la prueba de elección para la valoración de la presencia de isquemia, macular o periférica. La calidad de la AFG puede verse afectada por una mala midriasis, o por la presencia de una catarata o de sangre en el vítreo.
Los sistemas de campo amplio proporcionan información sobre la relación entre las complicaciones de la retinopatía diabética, tanto en la retina periférica como en la mácula1. La AFG de campo amplio captura hasta 200º de retina en una sola imagen, permitiendo la obtención de imágenes angiográficas de la retina previamente no fotografiables. Es útil en enfermedades como la retinopatía diabética, las oclusiones vasculares de la retina, la retinopatía de células falciformes y las uveítis, entre otras2. Permite una detección temprana de las lesiones periféricas en comparación con la AFG estándar3. Wessel et al.4 compararon las imágenes obtenidas con los siete campos convencionales y la angiografía de campo amplio, siendo esta última más sensible en el diagnóstico de patología vascular en pacientes con retinopatía diabética al mostrar 3,2 veces más área de retina. Hay que tener en cuenta que la imagen obtenida por los sistemas de campo amplio de la retina más periférica está magnificada5.
La AFG de campo amplio es una herramienta útil en la detección de isquemia periférica, lo cual puede tener implicaciones directas en el diagnóstico, el seguimiento y el tratamiento. Mugit et al.6 describieron el uso de la fotocoagulación periférica con láser patrón guiada por angiografía de campo amplio exclusivamente en las zonas de isquemia en pacientes con retinopatía diabética proliferativa (Figura 3). Wessel et al.7, en un estudio con angiografía de campo amplio, concluyeron que la isquemia periférica estaba significativamente relacionada con la presencia de edema macular diabético en pacientes con retinopatía diabética no tratada previamente. Patel et al.8 estudiaron las características angiográficas de 148 ojos con edema macular diabético refractarios al tratamiento con fotocoagulación láser. Tras calcular el índice de isquemia por angiografía de campo amplio, concluyeron que grandes áreas de isquemia na se correlacionan con falta de respuesta al tratamiento. Es posible que, en un futuro, la adopción de esta tecnología modifique la clasificación de la retinopatía diabética y el manejo de la enfermedad.
Azad et al.9 estudiaron el papel de la angiografía con RetCam en la retinopatía diabética. Tras estudiar 150 ojos, concluyeron que la gonioangiografía con RetCam es más sensible en el diagnóstico de neovasos en el ángulo iridocorneal que la gonioscopia, por lo que puede ser una técnica útil en la prevención de la progresión del glaucoma neovascular.
Las áreas de isquemia na secundarias a la oclusión capilar van a producir una falta de relleno de colorante, apreciándose como una zona hipofluorescente de extensión y localización variables. La red capilar de las zonas adyacentes es claramente visible. Es más frecuente en la retina nasal. La extensión de la isquemia, así como la retina periférica, son fácilmente visibles con sistemas de angiografía de campo amplio (Figura 6). El riesgo de conversión a retinopatía diabética proliferativa, entre otros factores, es proporcional a la magnitud del área de isquemia.
Según la distribución de las áreas de fuga, el edema macular diabético se clasifica angiográficamente (Figura 10) en:
En el edema macular diabético, el fluido comienza a acumularse en las capas más externas14. En general existe una buena correlación entre los hallazgos de la OCT y los de la AFG. La magnitud de la fuga de colorante en la AFG se correlaciona positivamente con el fluido observado en la OCT14. El edema macular quístico es un hallazgo frecuente en los pacientes con edema macular diabético respecto a otras patologías1. No hay una clara correlación entre su presencia y la agudeza visual. La típica forma de fuga cistoide en la AFG se correlaciona siempre con cambios quísticos en la OCT14,15, y es proporcional a la gravedad de esta14. Sin embargo, el patrón de hiperfluorescencia difusa no se correlaciona con una imagen de OCT predecible. Además, la OCT es más sensible en la detección de fluido subno que la AFG15.
Murakami et al.16 estudiaron la correlación entre las áreas de hiperfluorescencia y los hallazgos morfológicos en la OCT, y encontraron una mayor hiperfluorescencia en ojos con edema macular respecto a aquellos sin edema macular diabético, y que esta era proporcional al grosor de la retina y a la presencia de desprendimiento seroso del neuroepitelio. Este hallazgo sugiere que la hiperpermeabilidad vascular en la perifóvea contribuye a la patogenia del desprendimiento seroso del neuroepitelio.
En la planificación del tratamiento con fotocoagulación láser del edema macular diabético, tanto la OCT como la AFG son dos técnicas diagnósticas efectivas y seguras10,17. Sin embargo, la AFG es más precisa en la planificación del tratamiento con láser macular. Kozak et al.10 compararon la planificación del tratamiento con fotocoagulación focal en casos de edema macular diabético en 14 ojos, siendo significativamente mayor el número de impactos previstos usando la OCT como guía respecto a la angiografía fluoresceínica.
Los nuevos sistemas de fotocoagulación láser automatizados (por ejemplo NAVILAS) son un tratamiento prometedor en el edema macular diabético18. La integración de la AFG en la programación de la fotocoagulación permite una mayor precisión de la localización de los impactos láser, tanto en el edema macular diabético focal como en el difuso18,19.
La maculopatía isquémica se define como un aumento de la zona avascular foveal por pérdida de capilares. La AFG es, de momento, la técnica de elección para la detección y la cuantificación de la isquemia macular12. Un mayor grado de isquemia macular es un factor predictivo independiente de progresión de la isquemia. Sim et al.20 estudiaron los factores predictores de la progresión de la isquemia macular diabética, siendo la tasa de agrandamiento de la zona avascular foveal (ZAF) de un 5% a un 10% anual en ojos con isquemia establecida. Murakami et al.21 encontraron una asociación entre una ZAF más extensa y la presencia de espacios quísticos foveales con la existencia de microaneurismas en la red capital perifoveal (Figura 11).
La isquemia macular produce una disrupción en la capa de los elipsoides, con atrofia de las capas externas de la retina y la consiguiente pérdida visual22. La isquemia macular moderada o grave se asocia con una pérdida de agudeza visual, pero no las isquemias leves23. Se asocia con menor frecuencia a desprendimiento del neuroepitelio13. La falta de perfusión macular también produce una pérdida de las capas internas de la retina14.
Diversos estudios han evaluado el efecto de los tratamientos con antiangiogénicos sobre el tamaño de la zona avascular foveal. Nakamura et al.24 describieron un aumento de la isquemia macular tras el tratamiento con bevacizumab, aunque estos hallazgos no han sido evidenciados por otros autores25.
Sim et al.1 demostraron, con el uso de la angiografía de campo amplio, una relación directa entre la isquemia periférica y el área de la ZAF. Patel et al.8 demostraron que los ojos con mayores áreas de isquemia y mayor gravedad de la retinopatía diabética tenían menos respuesta al tratamiento de su edema macular diabético con fotocoagulación.
El daño endotelial secundario a la hiperglucemia produce cierre capilar e isquemia de la retina. La hipoxia favorece el aumento de la concentración vítrea de factores angiogénicos (vascular endotelial growth factor, VEGF, o insulin-like growth factor 1, IGF1, entre otros) que van a intervenir en el aumento de la permeabilidad vascular y en el desarrollo de la neovascularización secundaria a la isquemia en fases más avanzadas.
La angiografía fluoresceínica (AFG) es la prueba por excelencia para el estudio de la barrera hematona y de la vascularización na y coroidea, siendo una técnica diagnóstica valiosa en la patología vascular de la retina. En condiciones normales, la fluoresceína sódica no es capaz de atravesar la pared de los capilares de la retina, ya que las uniones endoteliales no permiten su paso. Sin embargo, en la microangiopatía diabética los capilares se encuentran afectados, haciéndose permeables al paso del colorante, al igual que ocurre con los neovasos, que carecen de uniones endoteliales.
Las causas de pérdida de visión asociadas a la retinopatía diabética pueden deberse tanto a la acumulación de fluido en la mácula (edema macular) como a la isquemia macular secundaria a la oclusión capilar. Ambas circunstancias son fácilmente evaluables por medio de la AFG (Figura 1).
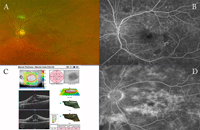
Figura 1. Retinopatía diabética. A) En el fondo de ojo aparecen lesiones como microaneurismas, exudados duros y algodonosos, que en su conjunto forman el espectro habitual de presentación de la retinopatía diabética. La AFG es clave para el análisis de la extensión y la gravedad tanto de la retinopatía diabética como del edema macular diabético. B) AFG con áreas de isquemia macular. C) SD-OCT: edema macular con desprendimiento del neuroepitelio. D) AFG correspondiente al caso C.
Papel de la angiografía fluoresceínica en la retinopatía diabética
El diagnóstico y la clasificación de la retinopatía diabética se realizan por exploración del fondo de ojo bajo midriasis. La presencia de neovasos determina el paso a retinopatía diabética proliferativa (Figura 2). Con la llegada de métodos no invasivos, como la tomografía de coherencia óptica (OCT), la AFG se realiza con menos frecuencia en la monitorización del paciente. Sin embargo, es una técnica diagnóstica que aporta gran información sobre el estado de la vascularización na. Permite la valoración, la cuantificación y la localización de las lesiones (por ejemplo las anomalías vasculares intranas o el arrosariamiento venoso), siendo más sensible que la biomicroscopía en la detección de ciertas lesiones, como los microaneurismas y los neovasos.
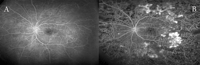
Figura 2. Retinopatía diabética. La presencia de neovasos representa el paso a retinopatía diabética proliferante. A) Retinopatía diabética no proliferativa. B) Retinopatía diabética proliferativa. Panretinofotocoagulación incompleta con penachos de neovasos sobre arcadas vasculares temporales.
La AFG es una prueba importante en la detección temprana de las complicaciones de la retinopatía diabética, pudiendo actuar a tiempo para disminuir la incidencia de alteraciones visuales irreversibles. Por otra parte, la AFG es la prueba de elección para la valoración de la presencia de isquemia, macular o periférica. La calidad de la AFG puede verse afectada por una mala midriasis, o por la presencia de una catarata o de sangre en el vítreo.
Los sistemas de campo amplio proporcionan información sobre la relación entre las complicaciones de la retinopatía diabética, tanto en la retina periférica como en la mácula1. La AFG de campo amplio captura hasta 200º de retina en una sola imagen, permitiendo la obtención de imágenes angiográficas de la retina previamente no fotografiables. Es útil en enfermedades como la retinopatía diabética, las oclusiones vasculares de la retina, la retinopatía de células falciformes y las uveítis, entre otras2. Permite una detección temprana de las lesiones periféricas en comparación con la AFG estándar3. Wessel et al.4 compararon las imágenes obtenidas con los siete campos convencionales y la angiografía de campo amplio, siendo esta última más sensible en el diagnóstico de patología vascular en pacientes con retinopatía diabética al mostrar 3,2 veces más área de retina. Hay que tener en cuenta que la imagen obtenida por los sistemas de campo amplio de la retina más periférica está magnificada5.
La AFG de campo amplio es una herramienta útil en la detección de isquemia periférica, lo cual puede tener implicaciones directas en el diagnóstico, el seguimiento y el tratamiento. Mugit et al.6 describieron el uso de la fotocoagulación periférica con láser patrón guiada por angiografía de campo amplio exclusivamente en las zonas de isquemia en pacientes con retinopatía diabética proliferativa (Figura 3). Wessel et al.7, en un estudio con angiografía de campo amplio, concluyeron que la isquemia periférica estaba significativamente relacionada con la presencia de edema macular diabético en pacientes con retinopatía diabética no tratada previamente. Patel et al.8 estudiaron las características angiográficas de 148 ojos con edema macular diabético refractarios al tratamiento con fotocoagulación láser. Tras calcular el índice de isquemia por angiografía de campo amplio, concluyeron que grandes áreas de isquemia na se correlacionan con falta de respuesta al tratamiento. Es posible que, en un futuro, la adopción de esta tecnología modifique la clasificación de la retinopatía diabética y el manejo de la enfermedad.

Figura 3. Retinopatía diabética con intensa isquemia periférica de predominio temporal. A) Estado basal. B) Cierre capilar periférico con zona central preservada. C) Estado tras la fotocoagulación láser periférica exclusivamente en la zona de isquemia. Se aprecian los impactos parcialmente pigmentados. D) AFG tras la fotocoagulación periférica.
Azad et al.9 estudiaron el papel de la angiografía con RetCam en la retinopatía diabética. Tras estudiar 150 ojos, concluyeron que la gonioangiografía con RetCam es más sensible en el diagnóstico de neovasos en el ángulo iridocorneal que la gonioscopia, por lo que puede ser una técnica útil en la prevención de la progresión del glaucoma neovascular.
Patrones patológicos en la angiografía fluoresceínica en la retinopatía diabética
Existen distintos patrones de fluorescencia anómala, por exceso o por defecto.Lesiones hipofluorescentes
El efecto pantalla se produce por un bloqueo de la fluorescencia normal debido a la existencia de cualquier lesión causante, la cual se diagnosticará mediante biomicroscopía o retinografía de fondo de ojo. Estas lesiones pueden ser:- Exudados duros, formados por depósitos lipídicos procedentes del torrente sanguíneo, que salen al espacio intersticial debido a la alteración de la barrera hematona interna. En la AFG van a bloquear discretamente la fluorescencia de las capas profundas desde tiempos precoces (Figura 4).
- Exudados blandos que se asocian a zonas de isquemia, por lo que se presentan como zonas localizadas de cierre capilar (Figura 4).
- Hemorragias nas y prenas que van a producir bloqueo de la fluorescencia (Figura 5).
- Hemorragia vítrea que produce una alteración de la calidad de la AFG y un grado de bloqueo variable en función de la magnitud del hemovítreo (Figura 5).
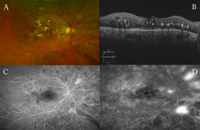
Figura 4. Efecto pantalla. A) Retinopatía diabética proliferante. B) SD-OCT: exudados duros maculares. C) AFG: tiempos precoces. Múltiples microhemorragias, exudados duros maculares y exudados algodonosos que bloquean la fluorescencia. D) AFG: tiempos tardíos. Neovasos.

Figura 5. Efecto pantalla. A) Hemorragia vítrea. B) Hemorragia subhialoidea. C y D) Hemorragia na profunda bajo la arcada vascular temporal inferior.
Las áreas de isquemia na secundarias a la oclusión capilar van a producir una falta de relleno de colorante, apreciándose como una zona hipofluorescente de extensión y localización variables. La red capilar de las zonas adyacentes es claramente visible. Es más frecuente en la retina nasal. La extensión de la isquemia, así como la retina periférica, son fácilmente visibles con sistemas de angiografía de campo amplio (Figura 6). El riesgo de conversión a retinopatía diabética proliferativa, entre otros factores, es proporcional a la magnitud del área de isquemia.
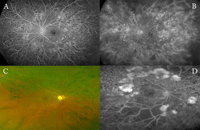
Figura 6. Isquemia na. Los sistemas de campo amplio son útiles en el estudio de la isquemia periférica. A y B) Isquemia periférica grave. C y D) Panretinofotocoagulación incompleta, con cierre capilar intenso en el cuadrante temporal inferior y neovascularización na.
Lesiones hiperfluorescentes
Se producen por los siguientes mecanismos:-
Fuga: por la alteración de las barreras hematonas. En la retinopatía diabética, las lesiones que producen fugas de colorante son:
- Microaneurismas, que constituyen un signo precoz de retinopatía diabética. En la AFG se ven como dilataciones focales hiperfluorescentes dispersos en el fondo de ojo (Figura 7). La AFG es más sensible en la detección de microaneurismas que la biomicroscopía, y además permite el diagnóstico diferencial con las microhemorragias, que como ya se ha detallado producen un bloqueo de la fluorescencia. Son dilataciones vasculares con ausencia de pericitos, por lo que tienen hiperpermeabilidad vascular. El paso de fluido al espacio intersticial se va a reflejar como un área de fuga en tiempos tardíos. Esta hiperfluorescencia se asocia con un engrosamiento de la retina adyacente10. La AFG puede comprobar el cierre de los microaneurismas tras el tratamiento con fotocoagulación focal11.
- Neovasos, que se producen de forma secundaria a la isquemia na. Se aprecia una hiperfluorescencia en etapas tardías por intensa fuga de colorante desde el tejido neovascular al espacio vítreo (Figura 8). Pueden localizarse en la papila, la retina e incluso el iris. La AFG es útil en el diagnóstico de una retinopatía diabética proliferativa incipiente, ya que es más sensible en la detección de neovasos que la biomicroscopía. La AFG permite realizar el diagnóstico diferencial con las anomalías microvasculares intrarnas, en las cuales la pérdida de colorante es mínima al espacio intrarno.
- Efecto ventana: se debe a la alteración del epitelio pigmentario de la retina, que va a permitir una mayor visualización de la circulación coroidea. Un ejemplo son las cicatrices nas tras el tratamiento con fotocoagulación láser (Figura 9).

Figura 7. Microaneurismas. En los tiempos precoces de la AFG aparecen como puntos hiperfluorescentes (A), y en tiempos tardíos muestran un grado variable de fuga de colorante (B).

Figura 8. A) Proliferación fibrovascular. B) La fase inicial de la AFG destaca los neovasos. C y D) En tiempos tardíos se produce una gran fuga de colorante hacia el vítreo.

Figura 9. Retinopatía diabética proliferativa. A y B) Hemorragias prernas y neovascularización na intensa asociada a áreas de cierre capilar. C y D) Panretinofotocoagulación dispersa completa, con regresión de los neovasos.
Clasificación angiográfica del edema macular diabético
La AFG demuestra la alteración de la barrera hematorna mediante la detección de áreas de fuga de colorante de los capilares de la retina. Hoy en día, la AFG se considera como el método más valioso para medir la isquemia na y la fuga de contraste a través de los capilares, no siendo superada aún por la OCT12.Según la distribución de las áreas de fuga, el edema macular diabético se clasifica angiográficamente (Figura 10) en:
- Edema macular focal: se producen fugas locales desde microaneurismas, frecuentemente rodeados de un anillo de exudados duros. La AFG localiza los aneurismas filtrantes para preparar su tratamiento con fotocoagulación focal si se encuentran fuera de la zona avascular foveal.
- Edema macular multifocal.
- Edema macular difuso: se produce por una alteración generalizada de los capilares nos con rotura extensa de la barrera hematorna y extravasación difusa de colorante. Se asocia con frecuencia a edema macular quístico. Gungel y Altan13 estudiaron la relación entre el desprendimiento del neuroepitelio y los hallazgos angiográficos, encontrando que el desprendimiento del neuroepitelio se encuentra con mayor frecuencia en ojos con maculopatía difusa.

Figura 10. Clasificación del edema macular diabético. A y B) Focal. C y D) Difuso.
En el edema macular diabético, el fluido comienza a acumularse en las capas más externas14. En general existe una buena correlación entre los hallazgos de la OCT y los de la AFG. La magnitud de la fuga de colorante en la AFG se correlaciona positivamente con el fluido observado en la OCT14. El edema macular quístico es un hallazgo frecuente en los pacientes con edema macular diabético respecto a otras patologías1. No hay una clara correlación entre su presencia y la agudeza visual. La típica forma de fuga cistoide en la AFG se correlaciona siempre con cambios quísticos en la OCT14,15, y es proporcional a la gravedad de esta14. Sin embargo, el patrón de hiperfluorescencia difusa no se correlaciona con una imagen de OCT predecible. Además, la OCT es más sensible en la detección de fluido subno que la AFG15.
Murakami et al.16 estudiaron la correlación entre las áreas de hiperfluorescencia y los hallazgos morfológicos en la OCT, y encontraron una mayor hiperfluorescencia en ojos con edema macular respecto a aquellos sin edema macular diabético, y que esta era proporcional al grosor de la retina y a la presencia de desprendimiento seroso del neuroepitelio. Este hallazgo sugiere que la hiperpermeabilidad vascular en la perifóvea contribuye a la patogenia del desprendimiento seroso del neuroepitelio.
En la planificación del tratamiento con fotocoagulación láser del edema macular diabético, tanto la OCT como la AFG son dos técnicas diagnósticas efectivas y seguras10,17. Sin embargo, la AFG es más precisa en la planificación del tratamiento con láser macular. Kozak et al.10 compararon la planificación del tratamiento con fotocoagulación focal en casos de edema macular diabético en 14 ojos, siendo significativamente mayor el número de impactos previstos usando la OCT como guía respecto a la angiografía fluoresceínica.
Los nuevos sistemas de fotocoagulación láser automatizados (por ejemplo NAVILAS) son un tratamiento prometedor en el edema macular diabético18. La integración de la AFG en la programación de la fotocoagulación permite una mayor precisión de la localización de los impactos láser, tanto en el edema macular diabético focal como en el difuso18,19.
La maculopatía isquémica se define como un aumento de la zona avascular foveal por pérdida de capilares. La AFG es, de momento, la técnica de elección para la detección y la cuantificación de la isquemia macular12. Un mayor grado de isquemia macular es un factor predictivo independiente de progresión de la isquemia. Sim et al.20 estudiaron los factores predictores de la progresión de la isquemia macular diabética, siendo la tasa de agrandamiento de la zona avascular foveal (ZAF) de un 5% a un 10% anual en ojos con isquemia establecida. Murakami et al.21 encontraron una asociación entre una ZAF más extensa y la presencia de espacios quísticos foveales con la existencia de microaneurismas en la red capital perifoveal (Figura 11).

Figura 11. Isquemia macular. Aumento de la zona avascular foveal asociado a áreas dispersas de cierre capilar en el polo posterior y microaneurismas.
La isquemia macular produce una disrupción en la capa de los elipsoides, con atrofia de las capas externas de la retina y la consiguiente pérdida visual22. La isquemia macular moderada o grave se asocia con una pérdida de agudeza visual, pero no las isquemias leves23. Se asocia con menor frecuencia a desprendimiento del neuroepitelio13. La falta de perfusión macular también produce una pérdida de las capas internas de la retina14.
Diversos estudios han evaluado el efecto de los tratamientos con antiangiogénicos sobre el tamaño de la zona avascular foveal. Nakamura et al.24 describieron un aumento de la isquemia macular tras el tratamiento con bevacizumab, aunque estos hallazgos no han sido evidenciados por otros autores25.
Sim et al.1 demostraron, con el uso de la angiografía de campo amplio, una relación directa entre la isquemia periférica y el área de la ZAF. Patel et al.8 demostraron que los ojos con mayores áreas de isquemia y mayor gravedad de la retinopatía diabética tenían menos respuesta al tratamiento de su edema macular diabético con fotocoagulación.
Bibliografía
- Sim DA, Keane PA, Rajendram R, Karampelas M, Selvam S, Powner MB, et al. Patterns of peripheral retinal and central macular ischemia in diabetic retinopathy as evaluated by ultra-wild field fluorescein angiography. Am J Ophthalmol. 2014. [Epub ahead of print].
- Patel M, Kiss S. Ultra-wilde-field fluorescein angiography in retinal disease. Curr Opin Ophthalmol. 2014;25(3):213-20.
- Kong M, Lee MY, Ham DI. Ultrawide-field fluorescein angiography for evaluation of diabetic retinopathy. Korean J Ophthalmol. 2012;26:428-31.
- Wessel MM, Aaker GD, Parlitsis G, Cho M, D’Amico DJ, Kiss S. Ultra-wide-field angiography improves the detection and classification of diabetic retinopathy. Retina. 2012;32:785-91.
- Oishi A, Hidaka J, Yoshimura N. Quantification of the image obtained with a wide-field scanning ophthalmoscope. Invest Ophthalmol Vis Sci. 2014;15:2424-31.
- Mugit MM, Marcellino GR, Henson DB, Young LB, Charles SJ, Turner GS, et al. Optos-guided pattern scan laser (Pascal)-targeted retinal photocoagulation in proliferative diabetic retinopathy. Acta Ophthalmol. 2013;91:251-8.
- Wessel MM, Nair N, Aaker GD, Ehrilich JR, D’Amico DJ, Kiss S. Peripheral retinal ischemia, as evaluated by ultra-wide field fluorescein angiography, is associated with diabetic macular oedema. Br J Ophthalmol. 2012;96:694-8.
- Patel RD, Messner LV, Teitelbaum B, Michel KA, Hariprasad SM. Characterization of isquemic index using ultra-wide field fluorescein angiography in patients with focal and diffuse recalcitrant diabetic macular edema. Am J Ophthalmol. 2013;155:1038-44.
- Azad R, Arora T, Sihota R, Chandra P, Mahajan D, Sain S, et al. Retcam fluorescein gonioangiography: a new modality for early detection of angle neovascularization in diabetic retinopathy. Retina. 2013;33(9):1902-7.
- Kozak I, El-Emam SY, Cheng L, Bartsch DU, Chhablani J, Freeman WR, et al. Fluorescein angiography versus optical coherence tomography-guided planning for macular laser photocoagulation in diabetic macular edema. Retina. 2014. [Epub ahead of print].
- Lee SN, Chhablani J, Chan CK, Wang H, Barteselli G, El-Emam S, et al. Characterization of microaneurysm closure after focal laser photocoagulation in diabetic macular edema. Am J Ophthalmol. 2013;155(5):905-12.
- Dmuchowska DA, Krasicki P, Mariak Z. Can optical coherence tomography replace fluorescein angiography in detection of ischemic diabetic maculopathy? Graefes Arch Clin Exp Ophthalmol. 2014;252(5):731-8.
- Gungel H, Altan C. The relationship between fundus fluorescein angiographic findings and serous macular detachment in diabetic macular edema. Retina. 2013; 33(9):1895-901.
- Yeung L, Lima VC, Garcia P, Landa G, Rosen RB. Correlation between spectral domain optical coherence tomography findings and fluorescein angiography patterns in diabetic macular edema. Ophthalmology. 2009;116(6):1158-67.
- Bolz M, Ritter M, Schneider M, Simader C, Scholda C, Schmidt-Erfurth U. A systematic correlation of angiography and high-resolution optical coherence tomography in diabetic macular edema. Ophthalmology. 2009;116(1):66-72.
- Murakami T, Uji A, Ogino K, Unoki N, Horii T, Yoshitake S, et al. Association between perfoveal hyperfluorescence and serous retinal detachment in diabetic macular edema. Ophthalmology. 2013;120:2596-603.
- Gallego-Pinazo R, Suelves-Cogollos AM, Dolz-Marco R, Arevalo JF, García Delpech S, Mullor JL, et al. Macular laser photocoagulation guided by spectral-domain optical coherence tomography versus fluorescein angiography for diabetic macular edema. Clin Ophthalmol. 2011;5:613-7.
- Kozak I, Oster SF, Cortes MA, Dowell D, Hartmann K, Kim JS, et al. Clinical evaluation and treatment accuracy in diabetic macular edema using navigated laser photocoagulator NAVILAS. Ophthalmology. 2011;118(6):1119-24.
- Chalam KV, Murthy RK, Brar V, Radhakrishnan R, Khetpal V, Grover S. Evaluation of a novel, non contact, automated focal laser with integrated (NAVILAS) florescein angiography for diabetic macular edema. Middle East Afr J Ophthalmol. 2012;19(1):158-62.
- Sim DA, Keane PA, Zarranz-Ventura J, Bunce CV, Fruttiger M, Patel PJ, et al. Predictive factors for the progression of diabetic macular ischemia. Am J Ophthalmol. 2014;156(4):684-92.
- Murakami T, Nishijima K, Sakamoto A, Ota M, Horii T, Yoshimura N. Foveal cystoid spaces are associated with enlarged foveal avascular zone and microaneurysms in diabetic macular edema. Ophthalmology. 2011;118(2):359-67.
- Lee DH, Kim JT, Jung DW, Joe SG, Yoon YH. The relationship between foveal ischemia and spectral-domain optical coherence tomography findings in ischemic diabetic macular edema. Invest Ophthalmol Vis Sci. 2013;54(2):1080-5.
- Sim DA, Keane PA, Zarranz-Ventura J, Fung S, Powner MB, Platteau E, et al. The effects of macular ischemia on visual acuity in diabetic retinopathy. Invest Ophthalmol Vis Sci. 2013;54:2353-60.
- Nakamura Y, Takeda N, Tatsumi T, Oshitari T, Arai M, Takatsuna Y, et al. Macular ischemia following intravitreal bevacizumab therapy for diabetic macular edema. Nihon Ganka Gakkai Zasshi. 2012;116(2):108-13.
- Michaelides M, Fraser-Bell S, Hamilton R, Kaines A, Egan C, Bunce C, et al. Macular perfusion determined by fundus fluorescein angiography at the 4-month time point in a prospective randomized trial of intravitreal bevacizumab or laser therapy in the management of diabetic macular edema (Bolt Study): Report 1. Retina. 2010;30(5):781-6.