Volumen 22 - Número 5 - Diciembre 2014
Tomografía de coherencia óptica en alta miopía
C. Mateo, M. Gómez-Resa
Departamento de Retina y Vítreo. Instituto de Microcirugía Ocular (IMO). Barcelona.
CORRESPONDENCIA
Carlos Mateo
E-mail: carlosmateo@me.com
E-mail: carlosmateo@me.com
Introducción
La miopía patológica es una de las causas más importantes de pérdida de visión y ceguera en todo el mundo, debido principalmente al desarrollo de diversas maculopatías1. La alta miopía, definida como un error refractivo mayor de -6 dioptrías o una longitud axial mayor de 26,5 mm, puede estar asociada a una gran variedad de cambios patológicos en la mácula, debido a un adelgazamiento de la retina y la coroides, que gracias a la tomografía de coherencia óptica (OCT) pueden ser fácilmente evaluados.Estafiloma posterior
El estafiloma posterior es una lesión característica de los ojos con alta miopía. Su prevalencia aumenta con el incremento de la longitud axial (ojos más miopes por definición) y con la edad avanzada. Está presente hasta en un 90% de los ojos con una miopía mayor de -28 dioptrías2. Curtin3 realizó una clasificación de los tipos de estafiloma posterior basada en la localización de la ectasia estudiada mediante oftalmoscopia indirecta. Describió diez tipos de estafilomas posteriores: cinco simples y cinco compuestos (Figura 1). Los ojos con estafiloma posterior tienen un riesgo mayor de presentar lesiones como neovascularización coroidea, atrofia corioretiniana, foveosquisis o agujeros maculares con o sin desprendimiento de retina4. Henaine-Berra et al.5, en un estudio observacional, encontraron diferencias entre ojos con alta miopía, en los que estas anomalías aparecieron en un 22% de los casos, mientras que en ojos con estafiloma posterior se presentaban en un 54%. Aquellos estafilomas que afectan al centro del área macular, como los tipos I, II y VI-X de Curtin, pueden desarrollar lo que se ha denominado maculopatía miópica traccional.

Figura 1. Clasificación de los estafilomas según Curtin3.
Maculopatía miópica traccional
En 1999, Takano y Kishi6, estudiando mediante OCT la mácula de pacientes con alta miopía y estafiloma posterior que presentaban levantamiento retiniano, describieron la existencia en algunos casos de desprendimiento foveal y separación de las capas de la retina (retinosquisis). Esta eventualidad ya había sido descrita como posibilidad en 1958 por Phillips y Dobbie7 para explicar el aspecto biomicroscópico de desprendimiento de retina en algunos pacientes con alta miopía. La OCT de dominio espectral ha permitido el estudio detallado del segmento posterior, y ha ayudado a resolver ciertos casos de pérdida de agudeza visual en pacientes con alta miopía sin cambios evidentes en el fondo de ojo (Figura 2).
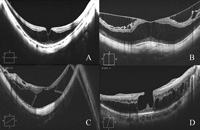
Figura 2. Diferentes aspectos tomográficos en pacientes con retinosquisis miópica. A) Foveosquisis externa sin signos de tracción vitreomacular visibles. B) Foveosquisis interna y externa. C) Foveosquisis con desprendimiento foveal y agujero lamelar externo. D) Foveosquisis externa con agujero lamelar interno y restos del córtex vítreo adheridos a la superficie interna de la retina.
La foveosquisis miópica es una alteración presente en los ojos con alta miopía con estafiloma posterior en un 9-34% de los casos8,9, ocasionada por un entorno en el que coexisten diversos mecanismos traccionales, como son las anomalías de la interfase vitreomacular, como membranas epiretinianas, vitreosquisis, adherencias anómalas de la hialoides posterior, junto con una membrana limitante interna rígida y la inextensibilidad de los vasos retinianos en el área macular10-12. Todo ello va a ocasionar una discordancia entre el crecimiento anteroposterior de las capas internas de la retina y el bloque formado por la esclera, la coroides y las capas externas. La rigidez de los vasos de la retina en relación al crecimiento anteroposterior del globo ocular fue descrita como posible causa de producción de foveosquisis por Ikuno et al.13 en 2005. Como consecuencia, se producen micropliegues en la superficie del polo posterior que pueden observarse con OCT14 (Figura 3). Aunque inicialmente este hallazgo fue descrito en ojos vitrectomizados13, también aparece en no vitrectomizados14. Por otra parte, la rigidez de la membrana limitante interna podría deberse a los restos de córtex vítreo adheridos, difícilmente diferenciables por OCT15,16 (Figura 4).
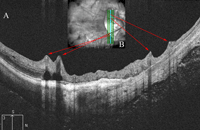
Figura 3. A) Perfil tomográfico de un corte vertical cercano a la papila donde se aprecia la tracción centrípeta ocasionada por la rigidez de los vasos retinianos. B) Imagen de fondo de ojo en la que se visualiza la zona de corte del scan B sobre la retina.
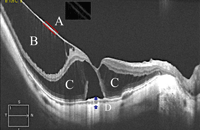
Figura 4. Aspecto tomográfico de una típica retinosquisis miópica, en el que se observa cómo la estructura traccional está compuesta por dos capas, probablemente la hialoides posterior aplicada junto con la membrana limitante interna. En el recuadro, aplicando filtros se distinguen ambas estructuras. B) Retinosquisis interna en la que se observan los axones proximales de las células junto al estiramiento de las células de Müller. C) Porción externa de la retinosquisis, en la que se aprecia el estiramiento de las asas de Henle. D) Aspecto típico de la coroides en la región del estafiloma, que se encuentra claramente reducida en grosor en comparación con los ojos emétropes.
En la biomicroscopia puede apreciarse, en algunos casos de foveosquisis, un aspecto microquístico de la mácula8. En la OCT aparece como un engrosamiento de la retina en el polo posterior, secundario a la división de la retina neurosensorial en una capa interna, más fina, y otra externa dentro del estafiloma posterior, separadas por un espacio hiporreflectivo con formaciones columnares que pueden corresponder a las células de Müller junto a fibras nerviosas estiradas (paquetes de los axones proximales de las células ganglionares). Posteriormente, la separación de los fotorreceptores del epitelio pigmentario de la retina conlleva la formación de un desprendimiento foveal, que finalmente puede ocasionar la aparición de un agujero macular completo8 (Figura 5). Pueden aparecer agujeros lamelares internos, asociados o no al desprendimiento foveal17. En ocasiones es difícil diferenciar una foveosquisis de larga evolución con agujero lamelar interno de un desprendimiento de retina por agujero macular (Figura 6).

Figura 5. Evolución natural de una foveosquisis miópica. A) Foveosquisis externa. B) Formación de desprendimiento foveal y rotura de las capas externas de la retina. C) Progresión a agujero macular de espesor completo.
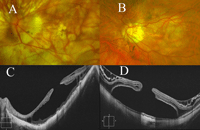
Figura 6. Utilidad de la OCT en el diagnóstico diferencial entre dos imágenes funduscópicas de levantamiento macular en con alta miopía (A y B). C) Foveosquisis de larga evolución, con formación de un agujero macular interno y desaparición de las estructuras columnares intraretinianas que conectan la retina interna con la externa. D) Desprendimiento foveal con agujero macular de espesor completo. La capa de fotorreceptores aparece como una línea hiperreflectiva separada del epitelio pigmentario de la retina.
El grosor de la foveosquisis no se correlaciona con la agudeza visual del paciente17, por lo que, además de los hallazgos en las pruebas de imagen, una anamnesis dirigida intentado detectar cambios subjetivos visuales, como la pérdida de la capacidad de lectura o la percepción de metamorfopsia, es fundamental para indicar la cirugía. Por otra parte, la OCT es útil en la valoración del pronóstico funcional de los pacientes con foveosquisis miópica. El examen minucioso de la imagen de OCT puede indicar en algunos casos el pronóstico visual, observando el estado de las asa de Henle y de las capas más externas de la retina (Figura 7).

Figura 7. Pronóstico de las foveosquisis miópicas según los hallazgos en la OCT. A) Foveosquisis de larga evolución. La desaparición de las conexiones entre la retina interna y externa augura un pronóstico ominoso. B) Retinosquisis con desprendimiento foveal; se observa irregularidad de las capas externas en los fotorreceptores y la membrana limitante externa. C) Los desprendimientos foveales con integridad anatómica de todas las capas externas de la retina tienen mejores resultados postoperatorios.
El componente traccional en la interfase vitreomacular tiene grados variables de afectación, siendo en ocasiones sutil, mientras que en otros casos puede evidenciarse de forma clara su presencia (Figura 8). Gaucher et al.17 encontraron esta asociación en un 45% de sus pacientes con foveosquisis. Puede presentarse como una membrana limitante interna a tensión, una membrana epiretiniana hiperreflectiva densa como principal causa de tracción tangencial, o una hialoides posterior engrosada parcialmente desprendida del polo posterior.

Figura 8. Alteraciones de la interfase vitreomacular. A) Foveosquisis con gran componente traccional visible con OCT. B) Foveosquisis con pseudoagujero macular donde no se observa estructura traccional evidente en la tomografía. C) Adhesión vitreomacular focal. Foveosquisis con desprendimiento foveal. D) Mismo paciente que en C tras el desprendimiento espontáneo de la porción interna de la esquisis de la hialoides posterior; no se observa cambio en el desprendimiento foveal.
La evolución de la maculopatía miópica traccional es variable y, aún hoy, impredecible. Ikuno et al.18 describieron varios subtipos de foveosquisis: progresiva, asociada a desprendimiento foveal o a agujero macular. La foveosquisis generalmente es el estadio inicial, precediendo al desarrollo de un desprendimiento foveal, que finalmente puede desembocar en un agujero macular de espesor completo. Según Gaucher et al.19, más de la mitad de los pacientes con foveosquisis progresan en un periodo de seguimiento de 3 años. Shimada et al.20 describieron la evolución natural de 207 casos de foveosquisis miópica durante una media de 36 meses. En su serie, un 4% de los casos se resolvieron de forma parcial o total debido a la liberación de la tracción, hecho también descrito por otros autores21. Un 12% progresaron, sobre todo aquellas foveosquisis más extensas. En una serie de Gaucher et al.17, la progresión de la foveosquisis, definida como una pérdida de agudeza visual y/o un engrosamiento de la retina, ocurrió en un porcentaje mayor. Los factores de riesgo identificados por estos autores fueron la presencia de estructuras premaculares o de desprendimiento foveal. Sin embargo, los estudios tienen seguimientos limitados en el tiempo y probablemente tiempos más largos demuestren una clara progresión en este tipo de patología miópica (Figura 9). En algunos de estos casos, tras muchos años se observa inicialmente una rotura de las capas externas de la retina que va seguida de un levantamiento progresivo y circundante en forma de “puente levadizo” (Figura 10). Shimada et al.20 estudiaron este proceso y describieron cuatro estadios, comenzando con una irregularidad de las capas externas de la retina, posiblemente consecuencia del aumento de la tracción transmitida a través de las estructuras columnares desde la retina interna. Este proceso puede producirse de forma progresiva o evolucionar rápidamente a un desprendimiento de retina por agujero macular (Figura 11).

Figura 9. Evolución en 5 años de una retinosquisis miópica. A) Foveosquisis de las capas externas de la retina (2009). B) Incremento progresivo del grosor macular debido al aumento de la longitud de las estructuras columnares (2012). C) Formación de una discontinuidad foveal de las capas externas con ligero descenso de la agudeza visual (2013). D) Desprendimiento foveal progresivo con lenta disminución de la visión central (2014).

Figura 10. Evolución natural. A) Foveosquisis miópica. B) Rotura de las capas externas de la retina. C) Signo del “puente levadizo”. Elevación de las capas externas de la retina y aumento del desprendimiento foveal.

Figura 11. A, B y C) Evolución progresiva de una retinosquisis en la que se observa la aparición de desprendimiento foveal hasta la aparición de desprendimiento de retina por agujero macular. D y E) Evolución aguda de una retinosquisis externa con buena visión a agujero macular completo con desprendimiento de retina y descenso brusco de la visión central.
En las foveosquisis miópicas, la vitrectomía pars plana combinada con indentación macular obtiene una mejoría de la agudeza visual en más de un 80% de los pacientes con alta miopía y estafiloma posterior, con resolución anatómica de la foveosquisis y del desprendimiento foveal en todos los casos, evitando el desarrollo de agujero macular con o sin desprendimiento de retina22.
Recientemente, El Rayes23 ha obtenido buenos resultados con la técnica de indentación supracoroidea, mediante la inyección de material viscoelástico usando un catéter de 450 micras, en casos de maculopatía miópica traccional tanto como técnica de primera elección como en casos de fracaso de una vitrectomía previa.
Agujero macular miópico
La miopía es la causa más frecuente de agujero macular antes de los 50 años de edad, y la edad media de aparición es menor que en la emetropía24. Jo et al.25 describieron dos tipos de agujeros maculares miópicos, con diferentes pronóstico y características. Los agujeros maculares con retinosquisis presentan bordes elevados y rectilíneos, que forman un ángulo agudo con el epitelio pigmentario de la retina, con un diámetro de apertura de la base mayor que el diámetro más interno, lo cual podría sugerir que se trata de una fase previa al desprendimiento de retina. En su serie de pacientes tratados mediante vitrectomía pars plana, los agujeros maculares sin retinosquisis obtuvieron un éxito anatómico en el 78% de los casos, en contraste con un 50% de los pacientes con retinosquisis asociada al agujero macular25. La asociación de retinosquisis con un agujero macular de espesor completo se asocia, pues, con peor pronóstico anatómico cuando se emplea únicamente la vitrectomía, mientras que la asociación de esta con indentación macular ha reportado mejores resultados26. La persistencia de la apertura del agujero macular mantiene el riesgo de progresión a desprendimiento de retina por agujero macular en el postoperatorio27. Por ello, en los casos con agujero macular con foveosquisis asociada, la indentación macular, además de obtener una tasa de cierre del agujero macular excelente, evitaría la progresión a desprendimiento de retina durante el postoperatorio en caso de fracaso26,27.Desprendimiento de retina por agujero macular
Desde los cuadros más iniciales y en su evolución, la maculopatía miópica traccional puede desembocar en la aparición de un desprendimiento de retina causado por el agujero macular, siendo la alta miopía la causa más importante de este tipo de desprendimiento de retina. Desde la simple inyección de gas expansible hasta las técnicas más complejas con inyección de aceite de silicona como taponador se han empleado para el tratamiento de este tipo de desprendimiento de retina. Tres son los factores que van a condicionar el pronóstico visual de estos pacientes: por una parte, la reaplicación retiniana; por otra, el cierre anatómico del agujero macular evitando la realización de fotocoagulación con láser alrededor; y en tercer lugar, evitar el uso de aceite de silicona como taponador, que no ha demostrado mejores resultados de cierre de los agujeros maculares y que produce, a largo plazo, tanto glaucoma como progresiva atrofia del nervio óptico en muchos casos.La vitrectomía pars plana es para muchos autores el tratamiento de elección de los desprendimientos de retina por agujero macular. Nadal et al.28, en una serie de 27 ojos con una longitud axial media de 32 mm, y empleando aceite de silicona como taponador, consiguieron el cierre del agujero macular en el 52% de los casos, y la reaplicación final de la retina en el 85% de ellos. Sin embargo, cuando se asocia la vitrectomía a procedimientos de indentación macular, algunos autores29-32 han reportado tasas de cierre del agujero macular superiores al 80% (Figura 12). Se han utilizado diferentes tipos de indentadores maculares para conseguir contrarrestar la tracción centrífuga del estafiloma (Figura 13). Dependiendo del diseño de la superficie de indentación, pueden observarse distintos perfiles en la OCT (Figura 14).

Figura 12. A) Retinografía de un paciente previamente intervenido de desprendimiento de retina por agujero macular, que presenta recidiva del desprendimiento cuando todavía existe gas intraocular. B) OCT que muestra el agujero macular persistente. C) Retinografía tras la reintervención con indentación macular y vitrectomía; el gas ha desaparecido. D) OCT que demuestra el cierre completo del agujero macular, el perfil de la indentación y la retina totalmente aplicada.

Figura 13. Diferentes tipos de indentación macular. A) Banda de silicona de 6 mm de ancho colocada desde nasal inferior a nasal superior pasando por el centro de la mácula. B) Indentador de Ando, fabricado en silicona y armazón de titanio para permitir ser doblado y obtener la indentación deseada. Se inserta un fibra óptica en la plataforma terminal para ayudar en la colocación bajo la mácula33. C) Indentador AJL, con una superficie de indentación de 8 mm de diámetro, construido en metacrilato recubierto de material de silicona, con un surco en la plataforma terminal para introducir una fibra óptica y facilitar su correcta colocación.

Figura 14. Diferentes perfiles obtenidos con OCT con diferentes técnicas e instrumentos de indentación. A) Banda de 4 mm de ancho cruzando el área macular. Se aprecian los bordes redondeados B) Indentador de Ando; bordes en ángulo recto con superficie de indentación plana, cuadrangular, de 5 mm. C) Borde redondeado y ligeramente convexo del indentador de AJL con diámetro de 8 mm.
Conclusión
La OCT ha supuesto una revolución en el conocimiento de la patología del ojo con alta miopía, convirtiéndose en una prueba sistemática necesaria para el diagnóstico preciso y el control riguroso de la evolución, que puede contribuir en muchos casos a establecer el pronóstico de los tratamientos.Bibliografía
- Green JS, Bear JC, Johnson GJ. The burden of genetically determined eye disease. Br J Ophthalmol. 1986;70:696-9.
- Hsiang HW, Ohno-Matsui K, Shimada N, et al. Clinical characteristics of posterior staphyloma in eyes with pathologic myopia. Am J Ophthalmol. 2008;146:102–110.
- Curtin BJ. The posterior staphyloma of pathologic myopia. Trans Am Ophthalmol Soc. 1977;75:67-86.
- Curtin BJ, Karlin DB. Axial length measurements and fundus changes of the myopic eye. I. The posterior fundus. Trans Am Ophthalmol Soc. 1970;68:312-34.
- Henaine-Berra A, Zand-Hadas IM, Fromow-Guerra J, García-Aguirre G. Prevalence of macular anatomic abnormalities in high myopia. Ophthalmic Surg Lasers Imaging Retina. 2013;44(2):140-4.
- Takano M, Kishi S. Foveal retinoschisis and retinal detachment in severely myopic eyes with posterior staphyloma. Am J Ophthalmol. 1999;128(4):472-6.
- Phillips CI, Dobbie JG. Posterior staphyloma and retinal detachment. Br J Ophthalmol. 1958;749-53.
- Benhamou N, Massin P, Haouchine B, Erginay A, Gaudric A. Macular retinoschisis in highly myopic eyes. Am J Ophthalmol. 2002;133(6):794-800.
- Panozzo G, Mercanti A. Optical coherence tomography findings in myopic traction maculopathy. Arch Ophthalmol. 2004;122:1455-60.
- Smiddy WE, Kim SS, Lujan BJ, Gregori G. Myopic traction maculopathy: spectral domain optical coherence tomographic imaging and a hypothesized mechanism. Ophthalmic Surg Lasers Imaging. 2009;40(2):169-73.
- Chebil A, Ben Achour B, Chaker N, Bouladi M, Charfi H, El Matri L. Factors linked to foveoschisis in high myopia. J Fr Ophtalmol. 2014;37(2):138-42.
- Sayanagi K, Ikuno Y, Tano Y. Tractional internal limiting membrane detachment in highly myopic eyes. Am J Ophthalmol. 2006;142(5):850-2.
- Ikuno Y, Gomi F, Tano Y. Potent retinal arteriolar traction as a possible cause of myopic foveoschisis. Am J Ophthalmol. 2005;139(3):462-7.
- Sayanagi K, Ikuno Y, Gomi F, Tano Y. Retinal vascular microfolds in highly myopic eyes. Am J Ophthalmol. 2005;139(4):658-63.
- Kobayashi H, Kishi S. Vitreous surgery for highly myopic eyes with foveal detachment and retinoschisis. Ophthalmology. 2003;110:1702-7.
- Bando H, Ikuno Y, Choi JS, Tano Y, Yamanaka I, Ishibashi T. Ultrastructure of internal limiting membrane in myopic foveoschisis. Am J Ophthalmol. 2005;139:197-9.
- Gaucher D, Haouchine B, Tadayoni R, et al. Long-term follow-up of high myopic foveoschisis: natural course and surgical outcome. Am J Ophthalmol. 2007;143:455-62.
- Ikuno Y, Sayanagi K, Soga K, et al. Foveal anatomical status and surgical results in vitrectomy for myopic foveoschisis. Jpn J Ophthalmol. 2008;52:269e76.
- Gaucher D, Haouchine B, Tadayoni R, et al. Long-term follow-up of high myopic foveoschisis: natural course and surgical outcome. Am J Ophthalmol. 2007;143:455e62.
- Shimada N, Tanaka Y, Tokoro T, Ohno-Matsui K. Natural course of myopic traction maculopathy and factors associated with progression or resolution. Am J Ophthalmol. 2013;156(5):948-57.
- Goldman DR, Duker JS. Spontaneous improvement of macular traction retinal detachment associated with myopic macular schisis. Ophthalmic Surg Lasers Imaging Retina. 2013;44(5):497-8.
- Mateo C, Gómez-Resa MV, Burés-Jelstrup A, Alkabes M. Surgical outcomes of macular buckling techniques for macular retinoschisis in highly myopic eyes. Saudi J Ophthalmol. 2013;27(4):235-9.
- El Rayes EN. Supra choroidal buckling in managing myopic vitreoretinal interface disorders: 1-year data. Retina. 2014;34(1):129-35.
- Kobayashi H, Kobayashi K, Okinami S. Macular hole and myopic refraction. Br J Ophthalmol. 2002;86:1269-73.
- Jo Y, Ikuno Y, Nishida K. Retinoschisis: a predictive factor in vitrectomy for macular holes without retinal detachment in highly myopic eyes. Br J Ophthalmol. 2012;96:197-200.
- Burés-Jelstrup A, Alkabes M, Gómez-Resa M, Mateo C. Visual and anatomical outcome after macular buckling for macular hole with associated foveoschisis in highly myopic eyes. Br J Ophthalmol. 2013;0:1-6.
- Alkabes M, Pichi F, Nucci P, Massaro D, Dutra Medeiros M, Corcóstegui B, et al. Anatomical and visual outcomes in high myopic macular hole (HM-MH) without retinal detachment: a review. Graefes Arch Clin Exp Ophthalmol. 2014;252(2):191-9.
- Nadal J, Verdaguer P, Canut MI. Treatment of retinal detachment secondary to macular hole in high myopia: vitrectomy with dissection of the inner limiting membrane to the edge of the staphyloma and long-term tamponade. Retina. 2012;32(8):1525-30.
- Theodossiadis G. The macular buckling procedure in the treatment of retinal detachment in highly myopic eyes with macular hole and posterior staphyloma. Retina. 2005;25:285-9.
- Tanaka T, Ando F, Usui M. Epiescleral macular buckling by semirigid shaped-rod exoplant for recurrent retinal detachment with macular hole in highly myopic eyes. Retina. 2005;25:147-51.
- Ripandelli G, Coppé AM, Fedeli R, Parisi V, D’Amico DJ, Stirpe M. Evaluation of primary surgical procedures for retinal detachment with macular hole in highly myopic eyes. A randomized comparison of vitrectomy versus posterior epiescleral buckling surgery. Ophthalmology. 2001;108:2258-65.
- Alkabes M, Burés-Jelstrup A, Salinas C, Medeiros MD, Ríos J, Corcóstegui B, et al. Macular buckling for previously untreated and recurrent retinal detachment due to high myopic macular hole: a 12-month comparative study. Graefes Arch Clin Exp Ophthalmol. 2014;252:571-81.
- Mateo C, Dutra MM, Alkabes M, Burés-Jelstrup A, Postorino M, Corcóstegui B. Illuminated Ando plombe for optimal positioning in highly myopic eyes with vitreoretinal diseases secondary to posterior staphyloma. Arch Ophthalmol. 2013;131:1359-62.