Volumen 22 - N˙mero 5 - Diciembre 2014
Tomografía de coherencia óptica en el edema macular diabético
M. G├│mez-Resa, B. Corc├│stegui
Departamento de Retina y Vítreo. Instituto de Microcirugía Ocular (IMO). Barcelona.
CORRESPONDENCIA
María Gómez-Resa
E-mail: mariagomezresa@hotmail.com
E-mail: mariagomezresa@hotmail.com
El edema macular diabético (EMD) es una de las complicaciones más temidas de los pacientes con diabetes mellitus1. Produce alteraciones visuales en un 1% a un 3% de la población diabética. Además de visión borrosa, que es la forma de presentación más frecuente, puede producir también metamorfopsia, alteración de la sensibilidad al contraste, fotofobia y otros síntomas. El EMD es la principal causa de ceguera en edad laboral en la población general2.
El EMD se caracteriza por una acumulación de líquido en la mácula como consecuencia de cambios anormales en los vasos sanguíneos de la retina4. Debido a una hiperglucemia mantenida, se produce un engrosamiento de la membrana basal de los vasos con pérdida de pericitos y células endoteliales. Esta lesión de los capilares perifoveales supone una rotura de la barrera hematoretiniana interna, que con la mediación de citocinas proinflamatorias como el VEGF (vascular endotelial growth factor), va a permitir el paso de fluido al espacio intersticial de la mácula, causando su engrosamiento o edema macular. Si este acúmulo afecta a la fóvea, podría producir sintomatología.
La biomicroscopía con lámpara de hendidura, la retinografía y la angiografía fluoresceínica son las herramientas más comunes en el diagnóstico del EMD y de la retinopatía diabética. Sin embargo, la tomografía de coherencia óptica (optical coherence tomography, OCT) aporta importante información adicional (Tabla 2).
La OCT es la herramienta diagnóstica y pronóstica más importante en el manejo del EMD14,15. Contribuye al entendimiento de la anatomía del EMD y del daño intraretiniano, y es la técnica de elección para el seguimiento del EMD y la monitorización del efecto del tratamiento, desplazando en este sentido a la angiografía fluoresceínica (AFG)15. La determinación de las características anatómicas del EMD (medidas del grosor retiniano, tipo morfológico y tracción macular) es fundamental para el abordaje terapéutico, para el pronóstico y para la valoración del efecto del tratamiento16.
La OCT es más sensible que la biomicroscopía en el diagnóstico del edema macular subclínico17. Pires et al.18 investigaron la relación entre el edema macular diabético subclínico y el desarrollo de edema macular clínicamente significativo (EMCS), encontrando que su presencia es un buen predictor de progresión a EMCS. En un estudio observacional se concluyó que aproximadamente la mitad de los edemas maculares diabéticos subclínicos (no detectados mediante biomicroscopía) progresan en un plazo de 2 años a un grosor mayor, necesitando algunos de ellos tratamiento19.
Además, la OCT da nueva información sobre los cambios morfológicos en el EMD, demostrando que es una afección clínica compleja con varias formas de presentación. Con la OCT son posibles los cambios estructurales y la evaluación cuantitativa del EMD (grosor retiniano y volumen). A pesar del papel fundamental que tiene la OCT en el diagnóstico y el seguimiento del EMD, aún no ha sustituido a la AFG en la valoración de la isquemia macular20.
La OCT de dominio espectral (SD-OCT) es más rápida y tiene mayor resolución que la OCT de dominio temporal, mostrando mayor detalle en un periodo de tiempo más breve, reduciendo así el artefacto del movimiento21. En un estudio comparativo de Liu et al.22 sobre la recomendación de tratamiento antiangiogénico según los hallazgos anatómicos en ambos tipos de OCT del mismo paciente, se evidenció que la indicación de tratamiento aumentaba con la SD-OCT al hallar con mejor resolución el fluido intraretiniano. Las medidas de grosor macular pueden variar entre OCT de dominio temporal y espectral, por lo que hay que tener prudencia en las comparaciones de medidas entre ambos aparatos. Rahimy et al.23 demostraron que la detección de fluido intraretiniano y subretiniano en el edema macular diabético por OCT de dominio espectral es comparable con los patrones de 6 y 25 líneas.
El EMD, en general, se caracteriza por un engrosamiento de la retina y por una pérdida del perfil foveal. Respecto a su morfología, se describen tres tipos.
El engrosamiento macular cistoide se aprecia como espacios de baja reflectividad divididos por membranas delgadas normorreflectivas (células de Müller). Afecta primero a las capas externas, pudiendo progresar afectando a todo el espesor de la retina. Hay tres grados de gravedad ascendente (a, b y c). El edema macular quístico se asocia con un mayor grosor foveal y una peor visión. La OCT de dominio espectral es más sensible que la AFG en la detección de edema macular quístico (Figura 2).
El desprendimiento neuroepitelial (DNE) puede presentarse aislado o acompañado de engrosamiento macular (Figura 3). Es el estadio más grave y representa la evolución final de un edema macular crónico con rotura de las paredes de los quistes y acúmulo de fluido subfoveal. Murakami et al.24 estudiaron la asociación entre la hiperfluorescencia perifoveal en la AFG y la presencia de desprendimiento de retina seroso, y concluyeron que la hiperpermeabilidad vascular en la perifóvea contribuye a la patogénesis del desprendimiento foveal en el EMD. Además, el DNE se asocia con maculopatía difusa, mientras que su ausencia se relaciona con isquemia macular25. Según Shereef et al.26, hay diferencias en el perfil topográfico del grosor macular en ojos con y sin desprendimiento neuroepitelial, siendo el grosor macular central menor en aquellos sin DNE, mientras que el grosor lateral es mayor. La patogénesis del desarrollo y la progresión del DNE no es del todo conocida. Gupta et al.27 describieron la existencia de comunicaciones en la retina externa entre el espacio intraretiniano y subretiniano, cuyo tamaño se relacionó directamente con el tamaño del DNE y la presencia de puntos hiperreflectivos en el espacio subretiniano, e inversamente con la agudeza visual. Muraoka et al.28 encontraron que un aumento en el diámetro medio de las vénulas superotemporal e inferotemporal estaba relacionado con la presencia de DNE. Sonoda et al.29 analizaron las muestras de humor vítreo de 52 ojos con edema macular diabético, encontrando que el DNE se relacionaba con niveles elevados de interleucina 6, lo cual indicaría que la inflamación puede desempeñar un papel importante en su desarrollo. Zhu et al.30 correlacionaron el DNE con niveles aumentados de ICAM-1 en el humor acuoso. Gupta et al.31 encontraron que la hipertensión arterial es un factor de riesgo independiente para el desarrollo de DNE, aunque Ghosh et al.32 no encontraron esta relación. El DNE frecuentemente se acompaña de focos hiperreflectivos en el espacio subretiniano, que son signos de mal pronóstico visual. Framme et al.19 asociaron la cantidad de estos focos hiperreflectivos con un mayor valor de la hemoglobina glucosilada.
La integridad de la línea de los elipsoides y la membrana limitante externa, y la ausencia de material hiperreflectivo en las capas externas, están relacionados con una mejor agudeza visual33. La presencia de este material hiperreflectivo en la retina externa podría ser un predictor de lesión de los fotorreceptores y de peor pronóstico visual después del tratamiento con vitrectomía34. La lesión de los fotorreceptores en la fóvea se aprecia como una disrupción de la membrana limitante externa o de la línea de los elipsoides (Figura 4), y se relaciona con un empeoramiento de la agudeza visual y de la sensibilidad de la retina medida con microperimetría. En la maculopatía isquémica se aprecia una disrupción de la línea de los elipsoides que puede evolucionar a cambios atróficos en las capas externas y a pérdida visual.
Según la nueva clasificación de la tracción vitreomacular del International Vitreomacular Traction Study Group8, el edema macular diabético actuaría como patología concurrente (Figura 6). La denominación de adhesión o tracción vitreomacular viene determinada por la influencia de los componentes de la interfase vitreoretiniana en la alteración del perfil foveal. Ambas serán a su vez focales (≤1500 µm) o amplias (>1500 µm) en función del diámetro de adhesión de la hialoides posterior a la retina interna. En combinación con ambos puede asociarse la presencia de una membrana epiretiniana.
Pai et al.35 describieron recientemente el “signo del volcán”. Se trata de un hallazgo tomográfico que se forma por una alteración de la interfase vitreomacular asociada a edemas maculares diabéticos crónicos, debida a la salida progresiva de fluido del espacio intraretiniano a la cavidad vítrea, resultando en una imagen hiperreflectiva vítrea premacular.
La presencia de alteraciones de la interfase vitreomacular puede tener valor pronóstico. Yoon et al.36 evaluaron el efecto de los fármacos antiangiogénicos en pacientes con alteraciones en la interfase vitreomacular (tracciones vitreomaculares y/o membranas epiretinianas), y concluyeron que tras la fase de carga se obtienen peores resultados visuales si se compara con ojos sin alteraciones vitreomaculares. Abe et al.37 describieron, usando OCT-3D, la presencia de pliegues en la membrana limitante interna, con expresión de colágeno tipo IV en el estudio postoperatorio. Estos pliegues indicarían la existencia de un componente traccional en el EMD.
El mapa topográfico es útil en la monitorización del desarrollo y de la localización del EMD, y en la valoración tanto de la elección del tratamiento, según la distancia a la fóvea del engrosamiento macular40, como en su seguimiento (Figura 9).
La OCT cuantifica los cambios en el grosor foveal y en el volumen macular después del tratamiento aplicado. El volumen macular evalúa toda la mácula, pero puede infraestimar los cambios en el grosor foveal inducidos por el tratamiento, por lo que para evaluar la eficacia del tratamiento es necesario estudiar ambos parámetros45.
Varios son los autores que han relacionado los cambios anatómicos en la OCT con los resultados visuales después del tratamiento. Ma et al.46 evaluaron la respuesta al tratamiento antiangiogénico una hora después de su aplicación, siendo la reducción del grosor macular central en este momento un factor predictor de buena respuesta tras un mes de seguimiento.
En la misma línea, Santos et al.47 concluyeron que la mejoría de la agudeza visual está relacionada con el grado de reducción del grosor macular central. El 44% de los pacientes que obtuvieron una reducción del grosor macular central >20% mejoraron 10 letras de agudeza visual, mientras que aquellos con una menor reducción tan solo ganaron dos letras.
En ensayos clínicos de evaluación de la eficacia de los tratamientos antiangiogénicos en el edema macular diabético se han utilizado criterios de retratamiento basados en el cambio de grosor macular central desde la última inyección, además de la agudeza visual22. El grosor central de la retina se ha visto directamente relacionado en algunos estudios con una mayor necesidad de retratamiento con fármacos antiangiogénicos48.
Factores de riesgo y patogenia
Los principales factores de riesgo para el desarrollo de EMD son el tiempo de evolución de la diabetes y la gravedad de la retinopatía diabética3. Otros factores de riesgo son los niveles elevados de HbA1c, la hipertensión arterial, la dislipidemia y el embarazo.El EMD se caracteriza por una acumulación de líquido en la mácula como consecuencia de cambios anormales en los vasos sanguíneos de la retina4. Debido a una hiperglucemia mantenida, se produce un engrosamiento de la membrana basal de los vasos con pérdida de pericitos y células endoteliales. Esta lesión de los capilares perifoveales supone una rotura de la barrera hematoretiniana interna, que con la mediación de citocinas proinflamatorias como el VEGF (vascular endotelial growth factor), va a permitir el paso de fluido al espacio intersticial de la mácula, causando su engrosamiento o edema macular. Si este acúmulo afecta a la fóvea, podría producir sintomatología.
Concepto y diagnóstico
El EMD se define como un engrosamiento de la mácula secundario al aumento de permeabilidad de los capilares retinianos en la retinopatía diabética. El Early Treatment Diabetic Retinopathy Study (ETDRS)5 clasificó el edema macular diabético con criterios biomicroscópicos o con fotografías estereoscópicas a color de 30º, independientemente de la agudeza visual (Tabla 1).

Tabla 1. Concepto de edema macular clínicamente significativo según el estudio ETDRS5.
La biomicroscopía con lámpara de hendidura, la retinografía y la angiografía fluoresceínica son las herramientas más comunes en el diagnóstico del EMD y de la retinopatía diabética. Sin embargo, la tomografía de coherencia óptica (optical coherence tomography, OCT) aporta importante información adicional (Tabla 2).
Tabla 2. Técnicas diagnósticas del edema macular diabético.
Papel de la tomografía de coherencia óptica en el edema macular diabético
La OCT es una técnica de imagen no invasiva y sin contacto que produce imágenes transversales de resolución micrométrica del tejido ocular. Mide la reflectividad óptica utilizando como fuente de emisión la luz. La OCT permite el examen detallado del grosor retiniano y la evaluación morfológica de las capas de la retina neurosensorial y de la interfase vitreoretiniana9,12. Se puede usar incluso sin midriasis farmacológica13. La OCT se ha integrado rápidamente en el diagnóstico y el manejo del EMD en la práctica clínica habitual, así como en los ensayos clínicos. Las medidas de OCT se usan en la mayoría de los estudios como objetivos primarios.La OCT es la herramienta diagnóstica y pronóstica más importante en el manejo del EMD14,15. Contribuye al entendimiento de la anatomía del EMD y del daño intraretiniano, y es la técnica de elección para el seguimiento del EMD y la monitorización del efecto del tratamiento, desplazando en este sentido a la angiografía fluoresceínica (AFG)15. La determinación de las características anatómicas del EMD (medidas del grosor retiniano, tipo morfológico y tracción macular) es fundamental para el abordaje terapéutico, para el pronóstico y para la valoración del efecto del tratamiento16.
La OCT es más sensible que la biomicroscopía en el diagnóstico del edema macular subclínico17. Pires et al.18 investigaron la relación entre el edema macular diabético subclínico y el desarrollo de edema macular clínicamente significativo (EMCS), encontrando que su presencia es un buen predictor de progresión a EMCS. En un estudio observacional se concluyó que aproximadamente la mitad de los edemas maculares diabéticos subclínicos (no detectados mediante biomicroscopía) progresan en un plazo de 2 años a un grosor mayor, necesitando algunos de ellos tratamiento19.
Además, la OCT da nueva información sobre los cambios morfológicos en el EMD, demostrando que es una afección clínica compleja con varias formas de presentación. Con la OCT son posibles los cambios estructurales y la evaluación cuantitativa del EMD (grosor retiniano y volumen). A pesar del papel fundamental que tiene la OCT en el diagnóstico y el seguimiento del EMD, aún no ha sustituido a la AFG en la valoración de la isquemia macular20.
La OCT de dominio espectral (SD-OCT) es más rápida y tiene mayor resolución que la OCT de dominio temporal, mostrando mayor detalle en un periodo de tiempo más breve, reduciendo así el artefacto del movimiento21. En un estudio comparativo de Liu et al.22 sobre la recomendación de tratamiento antiangiogénico según los hallazgos anatómicos en ambos tipos de OCT del mismo paciente, se evidenció que la indicación de tratamiento aumentaba con la SD-OCT al hallar con mejor resolución el fluido intraretiniano. Las medidas de grosor macular pueden variar entre OCT de dominio temporal y espectral, por lo que hay que tener prudencia en las comparaciones de medidas entre ambos aparatos. Rahimy et al.23 demostraron que la detección de fluido intraretiniano y subretiniano en el edema macular diabético por OCT de dominio espectral es comparable con los patrones de 6 y 25 líneas.
Estudio morfológico del edema macular diabético
La mejoría en los sistemas espectrales de OCT ha permitido el estudio detallado de todas las capas de la retina de forma individual, así como de la interfase vitreomacular. Debido a la gran cantidad de información obtenida, y a su valor pronóstico y como decisor terapéutico, es necesaria una clasificación basada en las imágenes de OCT. Panozzo et al.7 elaboraron una clasificación del edema macular diabético basada exclusivamente en los hallazgos de la OCT (Tabla 3). Los parámetros estudiados sin el grosor retiniano, la difusión, el volumen, la morfología y la presencia de tracción vitreomacular.El EMD, en general, se caracteriza por un engrosamiento de la retina y por una pérdida del perfil foveal. Respecto a su morfología, se describen tres tipos.

Tabla 3. Clasificación basada en OCT del edema macular diabético de Panozzo et al.7.
Tipos morfológicos de edema macular diabético
El patrón más frecuente de EMD es el espongiforme (Figura 1). Se presenta como una hiporreflectividad difusa y homogénea en las capas externas de la retina. El líquido se encuentra inicialmente entre las capas nuclear interna y plexiforme externa; más tarde también puede afectar a las capas plexiforme interna y la capa de fibras nerviosas de la retina hasta afectar a todo el grosor de la retina.

Figura 1. Edema macular diabético con engrosamiento en la retina temporal de tipo espongiforme, y pequeño desprendimiento seroso del neuroepitelio subfoveal. Hialoides posterior parcialmente desprendida.
El engrosamiento macular cistoide se aprecia como espacios de baja reflectividad divididos por membranas delgadas normorreflectivas (células de Müller). Afecta primero a las capas externas, pudiendo progresar afectando a todo el espesor de la retina. Hay tres grados de gravedad ascendente (a, b y c). El edema macular quístico se asocia con un mayor grosor foveal y una peor visión. La OCT de dominio espectral es más sensible que la AFG en la detección de edema macular quístico (Figura 2).

Figura 2. Edema macular quístico con adhesión vitreomacular.
El desprendimiento neuroepitelial (DNE) puede presentarse aislado o acompañado de engrosamiento macular (Figura 3). Es el estadio más grave y representa la evolución final de un edema macular crónico con rotura de las paredes de los quistes y acúmulo de fluido subfoveal. Murakami et al.24 estudiaron la asociación entre la hiperfluorescencia perifoveal en la AFG y la presencia de desprendimiento de retina seroso, y concluyeron que la hiperpermeabilidad vascular en la perifóvea contribuye a la patogénesis del desprendimiento foveal en el EMD. Además, el DNE se asocia con maculopatía difusa, mientras que su ausencia se relaciona con isquemia macular25. Según Shereef et al.26, hay diferencias en el perfil topográfico del grosor macular en ojos con y sin desprendimiento neuroepitelial, siendo el grosor macular central menor en aquellos sin DNE, mientras que el grosor lateral es mayor. La patogénesis del desarrollo y la progresión del DNE no es del todo conocida. Gupta et al.27 describieron la existencia de comunicaciones en la retina externa entre el espacio intraretiniano y subretiniano, cuyo tamaño se relacionó directamente con el tamaño del DNE y la presencia de puntos hiperreflectivos en el espacio subretiniano, e inversamente con la agudeza visual. Muraoka et al.28 encontraron que un aumento en el diámetro medio de las vénulas superotemporal e inferotemporal estaba relacionado con la presencia de DNE. Sonoda et al.29 analizaron las muestras de humor vítreo de 52 ojos con edema macular diabético, encontrando que el DNE se relacionaba con niveles elevados de interleucina 6, lo cual indicaría que la inflamación puede desempeñar un papel importante en su desarrollo. Zhu et al.30 correlacionaron el DNE con niveles aumentados de ICAM-1 en el humor acuoso. Gupta et al.31 encontraron que la hipertensión arterial es un factor de riesgo independiente para el desarrollo de DNE, aunque Ghosh et al.32 no encontraron esta relación. El DNE frecuentemente se acompaña de focos hiperreflectivos en el espacio subretiniano, que son signos de mal pronóstico visual. Framme et al.19 asociaron la cantidad de estos focos hiperreflectivos con un mayor valor de la hemoglobina glucosilada.

Figura 3. Edema macular diabético con componente espongiforme, quístico y desprendimiento seroso del neuroepitelio.
La integridad de la línea de los elipsoides y la membrana limitante externa, y la ausencia de material hiperreflectivo en las capas externas, están relacionados con una mejor agudeza visual33. La presencia de este material hiperreflectivo en la retina externa podría ser un predictor de lesión de los fotorreceptores y de peor pronóstico visual después del tratamiento con vitrectomía34. La lesión de los fotorreceptores en la fóvea se aprecia como una disrupción de la membrana limitante externa o de la línea de los elipsoides (Figura 4), y se relaciona con un empeoramiento de la agudeza visual y de la sensibilidad de la retina medida con microperimetría. En la maculopatía isquémica se aprecia una disrupción de la línea de los elipsoides que puede evolucionar a cambios atróficos en las capas externas y a pérdida visual.

Figura 4. Edema macular diabético. Se aprecia una acumulación de material hiperreflectivo intraretiniano y la alteración de la continuidad de la línea de los elipsoides. Ambos son factores de mal pronóstico visual.
El edema macular diabético y la tracción vitreomacular
La OCT permite estudiar la interfase vitreoretiniana de forma precisa. El EMD traccional está producido por una hialoides posterior parcialmente desprendida y tensa, que ejerce una tracción anteroposterior que induce o exacerba el EMD (Figura 5). La OCT es más sensible que la biomicroscopía en el diagnóstico de un desprendimiento posterior del vítreo parcial, y es crucial en la elección del tratamiento.
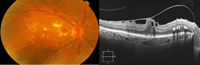
Figura 5. Retinografía: edema macular diabético con exudados duros perifoveales y aumento del brillo macular. SD-OCT: hialoides posterior parcialmente desprendida, tracciona de la superficie de la retina alterando el perfil foveal y produciendo quistes intraretinianos.
Según la nueva clasificación de la tracción vitreomacular del International Vitreomacular Traction Study Group8, el edema macular diabético actuaría como patología concurrente (Figura 6). La denominación de adhesión o tracción vitreomacular viene determinada por la influencia de los componentes de la interfase vitreoretiniana en la alteración del perfil foveal. Ambas serán a su vez focales (≤1500 µm) o amplias (>1500 µm) en función del diámetro de adhesión de la hialoides posterior a la retina interna. En combinación con ambos puede asociarse la presencia de una membrana epiretiniana.

Figura 6. Clasificación del edema macular diabético traccional según el International Vitreomacular Traction Study Group. Adhesión y tracción vitreomacular con edema macular diabético como patología concurrente. (A) Adhesión vitreomacular focal. (B) Adhesión vitreomacular amplia. (C) Tracción vitreomacular focal. (D) Tracción vitreomacular amplia.
Pai et al.35 describieron recientemente el “signo del volcán”. Se trata de un hallazgo tomográfico que se forma por una alteración de la interfase vitreomacular asociada a edemas maculares diabéticos crónicos, debida a la salida progresiva de fluido del espacio intraretiniano a la cavidad vítrea, resultando en una imagen hiperreflectiva vítrea premacular.La presencia de alteraciones de la interfase vitreomacular puede tener valor pronóstico. Yoon et al.36 evaluaron el efecto de los fármacos antiangiogénicos en pacientes con alteraciones en la interfase vitreomacular (tracciones vitreomaculares y/o membranas epiretinianas), y concluyeron que tras la fase de carga se obtienen peores resultados visuales si se compara con ojos sin alteraciones vitreomaculares. Abe et al.37 describieron, usando OCT-3D, la presencia de pliegues en la membrana limitante interna, con expresión de colágeno tipo IV en el estudio postoperatorio. Estos pliegues indicarían la existencia de un componente traccional en el EMD.
Otros hallazgos cualitativos
Otros hallazgos que pueden evaluarse con OCT son:- Exudados duros (Figura 7): se aprecian como puntos de hiperreflectividad intraretiniana que producen una sombra posterior. Se asocian a zonas de hiperpermeabilidad (por ejemplo microaneurismas).
- Exudados algodonosos: aparecen como lesiones hiperreflectivas en la capa de fibras nerviosas de la retina.
- Hemorragias (Figura 8): tanto las hemorragias intraretinianas como las preretinianas van a producir un bloqueo de la reflectividad, impidiendo el estudio de las estructuras posteriores a ellas.
- Desprendimiento de retina traccional (Figura 8).
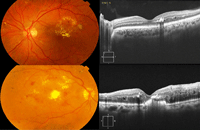
Figura 7. Exudados duros circinados alrededor de un microaneurisma. Exudados duros subfoveales con engrosamiento de la retina de componente espongiforme.

Figura 8. Retinopatía diabética proliferante. (A) Neovascularización del disco óptico con hemorragia preretiniana. (B) La sangre impide evaluar las estructras posteriores. (C) Proliferación fibrovascular que produce desprendimiento de retina traccional con afectación macular (D).
Con la OCT también puede evaluarse el efecto del tratamiento láser macular sobre las capas de la retina. El láser convencional produce una atrofia de las capas externas de la retina. Sin embargo, no produce cambios en el grosor de la coroides a corto plazo, estudiada con SD-OCT38. Soiberman et al.39 demostraron, tras el análisis con SD-OCT de las zonas tratadas, que el láser subumbral preserva la integridad de la capa de fotorreceptores. Tras el tratamiento con panretinofotocoagulación láser puede haber cambios en la mácula y una caída temporal de la agudeza visual.
Estudio cuantitativo del edema macular diabético
Inicio del tratamiento del edema macular diabético
La OCT ha permitido realizar medidas objetivas del grosor retiniano en el EMD. Esta medida es de gran relevancia, ya que se ha relacionado con la agudeza visual, además de otros factores que pueden influir. La medida del grosor macular central sirve, según muchos protocolos, para decidir el inicio del tratamiento del EMD, aunque existe controversia respecto al valor umbral.El mapa topográfico es útil en la monitorización del desarrollo y de la localización del EMD, y en la valoración tanto de la elección del tratamiento, según la distancia a la fóvea del engrosamiento macular40, como en su seguimiento (Figura 9).

Figura 9. (A) En la retinografía se aprecian microaneurismas y exudados duros maculares, asociados a un engrosamiento retiniano en el mapa topográfico. (B) Después de un año tras el tratamiento con fotocoagulación focal, se aprecian los impactos de láser pigmentados, con resolución completa del edema y desaparición de la exudación lipídica.
Monitorización del edema macular diabético
La tomografía de coherencia óptica tiene un importante valor en el seguimiento de la enfermedad. Permite evaluar la respuesta a los distintos tratamientos: fotocoagulación41, antiangiogénicos42, corticoides intravítreos43, subtenonianos44 o cirugía44.La OCT cuantifica los cambios en el grosor foveal y en el volumen macular después del tratamiento aplicado. El volumen macular evalúa toda la mácula, pero puede infraestimar los cambios en el grosor foveal inducidos por el tratamiento, por lo que para evaluar la eficacia del tratamiento es necesario estudiar ambos parámetros45.
Varios son los autores que han relacionado los cambios anatómicos en la OCT con los resultados visuales después del tratamiento. Ma et al.46 evaluaron la respuesta al tratamiento antiangiogénico una hora después de su aplicación, siendo la reducción del grosor macular central en este momento un factor predictor de buena respuesta tras un mes de seguimiento.
En la misma línea, Santos et al.47 concluyeron que la mejoría de la agudeza visual está relacionada con el grado de reducción del grosor macular central. El 44% de los pacientes que obtuvieron una reducción del grosor macular central >20% mejoraron 10 letras de agudeza visual, mientras que aquellos con una menor reducción tan solo ganaron dos letras.
En ensayos clínicos de evaluación de la eficacia de los tratamientos antiangiogénicos en el edema macular diabético se han utilizado criterios de retratamiento basados en el cambio de grosor macular central desde la última inyección, además de la agudeza visual22. El grosor central de la retina se ha visto directamente relacionado en algunos estudios con una mayor necesidad de retratamiento con fármacos antiangiogénicos48.
Estudio de la coroides en la retinopatía diabética
Lee et al.49, tras analizar 203 ojos con SD-OCT, concluyeron que el grosor coroideo subfoveal es mayor en los pacientes con retinopatía diabética, pero sin embargo no hay diferencias respecto al grosor coroideo en los pacientes con EMD cuando se comparan con un grupo control sin EMD. Laíns et al.47 describieron una reducción del grosor coroideo en pacientes con retinopatía diabética y edema macular diabético tratados con fármacos antiangiogénicos intravítreos, con una correlación directa con el número de inyecciones recibidas. Este grosor también disminuye en ojos panretinofotocoagulados.Bibliografía
- Watkins PJ. Retinopathy. Br J Ophthalmol. 2003;326:924-6.
- Saaddine JB. Projection of diabetic retinopathy and other major eye diseases among people with diabetes mellitus. Arch Ophthalmol. 2008;126:1740-7.
- Klein R. The Wisconsin epidemiology study of diabetic retinopathy. Diabetic macular edema. Ophthalmology. 1984;91:1464-74.
- Ferris FL. Macular edema. A complication of diabetic retinopathy. Survey of Ophthalmol. 1984;28:452-61.
- Early Treatment Diabetic Retinopathy Study Research Group. Results from the Early Treatment Diabetic Retinopathy Study. Ophthalmology. 1991;98:739-840.
- Lang GE. Optical coherence tomography findings in diabetic retinopathy. Dev Ophthalmol. 2007;39:31-47.
- Panozzo G, Parolini B, Gusson E, Mercanti A, Pinackatt S, Bertoldo, et al. Diabetic macular edema: an OCT-based classification. Semin Ophthalmol. 2004;19:13-20.
- Duker JS, Kaiser PK, Binder S, de Smet MD, Gaudric A, Reichel E, et al. The International Vitreomacular Traction Study Group classification of vitreomacular adhesion, traction, and macular hole. Ophthalmology. 2013;120(12):2611-9.
- Lang GE. Optical coherence tomography findings in diabetic retinopathy. Dev Ophthalmol. 2007;39:31-47.
- Browning DJ, McOwen MD, Bowen RM Jr, O’Marah TL. Comparison of the clinical diagnosis of diabetic macular edema with diagnosis by optical coherence tomography. Ophthalmology. 2004;111(4):712-5.
- 11. Massin P, Duguid G, Erginay A, Haouchine B, Gaudric A. Optical coherence tomography for evaluating diabetic macular edema before and after vitrectomy. Am J Ophthalmol. 2003;135(2):169-77.
- Giovannini A, Amato G, Mariotti C, Scassellati-Sforzolini B. Optical coherence tomography findings in diabetic macular edema before and after vitrectomy. Ophthalmic Surg Lasers. 2000;31(3):187-91.
- Medina FJ, Callén CI, Rebolleda G, Muñoz-Negrete FJ, Callén MJ, del Valle FG. Use of nonmydriatic spectral-domain optical coherence tomography for diagnosing diabetic macular edema. Am J Ophthalmol. 2012;153(3):536-43.
- Baskin DE. Optical coherence tomography in diabetic macular edema. Curr Opin Ophthalmol. 2010;21:172-7.
- Health Quality Ontario. Optical coherence tomography for age-related macular degeneration and diabetic macular edema: an evidence-based analysis. Ont Health Technol Assess Ser. 2009;9(13):1-22.
- Koleva-Georgieva DN, Sivkova NP. Types of diabetic macular edema assessed by optical coherence tomography. Folia Med (Plovdiv). 2008;50(3):30-8.
- Hannouche RZ, Avila MP. Detection of diabetic foveal edema with biomicroscopy, fluorescein angiography and optical coherence tomography. Arg Bras Oftalmol. 2008;71(5):759-63.
- Pires I, Santos AR, Nunes S, Lobo C, Cunha-Vaz J. Subclinical macular edema as a predictor of progression to clinically significant macular edema in type 2 diabetes. Ophthalmologica. 2013;230:201-6.
- Framme C, Schweizer P, Imesch M, Wolf S, Wolf-Schnurrbusch U. Behavior of SD-OCT-detected hyperreflective foci in the retina of anti-VEGF-treated patients with macular edema. Invest Ophthalmol Vis Sci. 2012;53:5814-8.
- Dmuchowska DA, Krasicki P, Mariak Z. Can optical coherence tomography replace fluorescein angiography in detection of ischemic diabetic maculopathy? Graefes Arch Clin Exp Ophthalmol. 2014;252(5):731-8.
- Al-Iatayfeh MM, Sun Jk, Ajello LP. Ocular coherence tomography and diabetic eye disease. Semin Ophthalmol. 2010;25;192-7.
- Liu MM, Wolfson Y, Bressler SB, Do DV, Ying HS, Bressler NM. Comparison of time- and spectral-domain optical coherence tomography in management of diabetic macular edema. Invest Ophthalmol Vis Sci. 2014;55(3):1370-7.
- Rahimy E, Rayess N, Maguire JI, Hsu J. Radial versus raster spectral-domain optical coherence tomography scan patterns for detection of macular pathology. Am J Ophthalmol. 2014. doi: 10.1016/j.ajo.2014.05.013.
- Murakami T, Uji A, Ogino K, Unoki N, Horii T, Yoshitake S, et al. Association between perifoveal hyperfluorescence and serous retina detachment in diabetic macular edema. Ophthalmology. 2013;120(12):2596-603.
- Gungel H, Altan C. The relationship between fundus fluorescein angiographic findings and serous macular detachment in diabetic macular edema. Retina. 2013;33(9):1895-901.
- Shereef H, Comyn O, Sivaprasad S, Hykin P, Cheung G, Narendran N, et al. Differences in the topographic profiles of retinal thickening in eyes with and without serous macular detachment associated with diabetic macular oedema. Br J Ophthalmol. 2014;98(2):182-7.
- Gupta A, Raman R, Mohana K, Kulothungan V, Sharma T. Communications between intraretinal and subretinal space on optical coherence tomography of neurosensory retinal detachment in diabetic macular edema. Oman J Ophthalmol. 2013;6:183-8.
- Muraoka Y, Murakami T, Akagi T, Uji A. Association between venular dilation and serous retinal detachment in diabetic macular edema. Retina. 2014;34:725-31.
- Sonoda S, Sakamoto T, Yamashita T, Shirasawa M, Otsuka H, Sonoda Y. Retinal morphologic changes and concentrations of cytocines in eyes with diabetic macular edema. Retina. 2014;34:741-8.
- Zhu D, Zhu H, Wang C, Yang D. Intraocular soluble intracellular adhesion molecule-1 correlates with subretinal fluid height of diabetic macular edema. Indian J Ophthalmol. 2014;62:295-8.
- Gupta A, Raman R, Kulothungan V, Sharma T. Association of systemic and ocular risk factors with neurosensory retinal detachment in diabetic macular edema: a case-control study. BMC Ophthalmol. 2014;9:47.
- Ghosh S, Bansal P, Shejao H, Hegde R, Roy D, Biswas S. Correlation of morphological pattern of optical coherence tomography in diabetic macular edema with systemic risk factors in middle aged males. Int Ophthalmol. 2014. Epub ahead of print.
- Uji A, Murakami T, Unoki N, Ogino K, Horii T, Yoshitake S, et al. Parallelism for quantitative image analysis of photoreceptor-retinal pigment epithelium complex alterations in diabetic macular edema. Invest Ophthalmol Vis Sci. 2014;55(5):3361-7.
- Nishijima K, Murakami T, Hirashima T, Uji A. Hyperreflective foci in outer retina predictive of photoreceptor damage and poor vision after vitrectomy for diabetic macular edema. Retina. 2014;34:732-40.
- Pai SA, Hussain N, Hebri SP, Lootah AM, Dekhaim MA. Volcano like pattern in optical coherence tomography in chronic diabetic macular edema. Saudi J Ophthalmol. 2014;28(2):157-9.
- Yoon D, Rusu I, Barbazetto I. Reduced effect of anti-vascular endothelial growth factor agents on diabetics with vitreomacular interface abnormalities. Int Ophthalmol. 2013. Epub ahead of print.
- Abe S, Yamamoto T, Kashiwagi Y, Kirii E, Goto S, Yamashita H. Three-dimensional imagining of the inner limiting membrane folding on the vitreomacular interface in diabetic macular edema. Jpn J Ophthalmol. 2013;57:553-62.
- Adhi M, Alwassia AA, Duker JS. Analysis of choroidal thickness in eyes treated with focal laser photocoagulation using SD-OCT. Can J Ophthalmol. 2013;48:535-8.
- Soiberman U, Goldstein M, Pianka P, Loewenstein A, Goldenberg D. Preservation of the photoreceptor layer following subthreshold laser treatment for diabetic macular edema as demonstrated by SD-OCT. Invest Ophthalmol Vis Sci. 2014;55(5):3054-9.
- Shrestha A, Maharjan N, Shrestha A, Thapa R, Poudyal G. Optical coherence tomographic assessment of macular thickness and morphological patterns in diabetic macular edema: prognosis after modified grid photocoagulation. Nepal J Ophthalmol. 2012;4(1):128-33.
- Perente I, Alkin Z, Ozkaya A, Dardabounis D, Ogreden TA, Konstantinidis A, et al. Med Hypothesis Discov Innov Ophthalmol. 2014;3(1):9-16.
- Comyn O, Sivaprasad S, Peto T, Neveu MM, Holder GE, Xing W, et al. A randomized trial to assess functional and structural effects of ranibizumab versus laser in diabetic macular edema (the LUCIDATE study). Am J Ophthalmol. 2014;157(5):960-70.
- Lazic R, Lukic M, Boras I, Draca N, Vlasic M, Gabric N, et al. Treatment of anti-vascular endothelial growth factor-resistant diabetic macular edema with dexamethasone intravitreal implant. Retina. 2014;34:719-24.
- Nonomura S, Oshitari T, Arai M, Sato E, Takatsuna Y, Baba T, et al. The effect of posterior sub-Tenon’s capsule triamcinolone acetonide injection to that of pars plana vitrectomy for diabetic macular edema. Clin Ophthalmol. 2014;30(8):825-30.
- Lima-Gómez V, Blanco-Hernández DM. Disparity between foveal thickness and macular volumen in diabetic macular edema. Cir Cir. 2012;80:25-30.
- Ma DJ, Park HK, Woo SJ. Predicting 1-month response of macular edema to intravitreal bevacizumab from 1-hour response. Can J Ophthalmol. 2014;49(3):267-72.
- Santos AR, Gómez SC, Figueira J, Numes S, Lobo CL, Cunha-Vaz JG. Degree of decrease in central retinal thickness predicts visual acuity response to intravitreal ranibizumab in diabetic macular edema. Ophthalmologica. 2014;231:16-22.
- Mushtag B, Crosby NJ, Dimopoulos AT, Lip PL, Stavrou P, El-Sherbiny, et al. Effect of initial retinal thickness on outcome of intravitreal bevacizumab therapy for diabetic macular edema. Clin Ophthalmol. 2014;28:807-12.
- Lee HK, Lim JW, Shin MC. Comparison of choroidal thickness in patients with diabetes by spectral-domain optical coherence tomography. Korean J Ophthalmol. 2013;27:433-9.