Volumen 21 - Número 5 - Diciembre 2013
Linfoma intraocular primario
A. Adán, L. PelegrÃn
Instituto Clínic de Oftalmología. Hospital Clínic de Barcelona. Barcelona
CORRESPONDENCIA
Alfredo Adán
E-mail: amadan@clinic.ub.es
E-mail: amadan@clinic.ub.es
Definición y epidemiología
El linfoma intraocular primario es una variante del linfoma primario del SNC (SNC) que afecta a la retina, con síntomas de predominio ocular1. Es una neoplasia maligna rara clasificada típicamente como un linfoma difuso de células B grandes que con más frecuencia se desarrolla en poblaciones mayores de 50 años. El Linfoma primario vitreo retiniano (LPVR) se presenta comúnmente como un síndrome de enmascaramiento a modo de uveítis posterior y tiene un origen multicéntrico con tropismo por la retina y el SNC. La incidencia de LPVR es difícil de estimar debido a que no existe ninguna base de datos central para esta enfermedad.Por el contrario, la incidencia del linfoma primario del SNC es bien conocida por el Registro de Tumores Cerebrales Central de EE.UU., y esto resulta útil para poder hacer una estimación de los casos de LPVR. Se estima una incidencia de 380 casos de LPVR al año en EE.UU.2. Más del 15% de los pacientes con linfoma primario del SNC desarrollan linfoma intraocular, que por lo general ocurre en la retina o en el vítreo, o en ambos3. Por el contrario, el 65% al 90% de los pacientes con LPVR desarrollan linfoma del SNC en una media de 29 meses4. El LPVR tiene una morbilidad y un pronóstico vital malos debido a su origen multicéntrico en la retina y el SNC.
Clínica
El linfoma primario intraocular, desde el punto de vista clínico, debe sospecharse ante un cuadro de uveítis intermedia o posterior crónica con respuesta variable a los corticoides y de localización bilateral en pacientes mayores de 60 años. Los pacientes con frecuencia sólo refieren miodesopsias. El retraso en el diagnóstico por la falta de sospecha clínica puede ser, de promedio, de unos 24 meses, lo que puede condicionar el pronóstico vital del paciente y la posibilidad de desarrollar el linfoma en el SNC.La mayoría de los casos tienen poca inflamación del segmento anterior sin presencia de sinequias posteriores, y en ocasiones puede haber células en la cámara anterior y precipitados gruesos endoteliales. Por lo general las células linfoides se limitan a la retina, el espacio subrretiniano y la cavidad vítrea. El aspecto clínico de las lesiones en la etapa inicial es de infiltrados subretinianos multifocales de localización posterior o periférica, que pueden asemejarse a cuadros de manchas blancas en el fondo de ojo, procesos granulomatosos tipo sarcoidosis5,6 (Figura 1). En fases más avanzadas las lesiones coalescen y adoptan una apariencia más necrótica, con localización retiniana o subretiniana (Figuras 2A y 2B). El aspecto necrótico hace que deba realizarse el diagnóstico diferencial con cuadros infecciosos, como el síndrome de necrosis retiniana aguda o la toxoplasmosis diseminada. El edema macular cistoide, que se encuentra comúnmente en las uveítis posteriores de otro origen, es raro en el LPVR. La agudeza visual dependerá de la localización de las lesiones, pero en la etapa inicial de la enfermedad puede ser buena y los síntomas oculares limitarse a miodesopsias.

Figura 1. Lesiones subretinianas multifocales en la zona temporal en un paciente con linfoma primario retiniano.
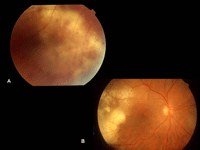
Figura 2. A. Lesiones retinianas de aspecto necrótico con células en el vítreo en un paciente con linfoma primario retiniano. B. Lesiones subretinianas en un paciente con linfoma primario retiniano.
Anatomía patológica
Aunque la exploración oftalmológica y las pruebas de imagen son complementos útiles, el estándar para el diagnóstico del LPVR es la identificación de células linfoides en la muestra intraocular. Por lo general esto requiere una vitrectomía diagnóstica con aspirado vítreo y en ocasiones biopsia endorretiniana con aspirado subretiniano7. En los casos con lesiones de localización subretiniana está indicada la biopsia endorretiniana con aspirado subretiniano. La obtención de la muestra se realiza mediante vitrectomía pars plana por tres vías y aspirado de las células del vítreo bajo aire en la cavidad vítrea. Esta maniobra permite obtener un volumen adecuado de muestra (1-2 ml) y de muestra no diluida del vítreo con una mayor concentración de células. Las células del LPVR suelen sufrir fácilmente necrosis, por lo que el procesamiento de la muestra debe ser rápido y valorado por un patólogo experto en muestras intraoculares. La citología y la histopatología son claves para el diagnóstico, y se caracterizan por presentar linfocitos atípicos, con núcleos grandes, irregulares, nucléolos prominentes y citoplasma basófilo escaso (Figura 3)8. La monoclonalidad, ya sea una población de células B con restricción de cadenas lambda o kappa, o una población de células T, se observa mediante técnicas de inmunohistoquímica o citometría de flujo. La inmunohistoquímica con tinciones CD20+ y Ki67 es útil para demostrar la población de células B y su grado de proliferación celular (Figuras 4A y 4B). La negatividad de células linfoides en el vítreo no excluye el diagnóstico de LPVR, ya que en ocasiones éstas se encuentran en el espacio subretiniano o infiltrando la retina (Figura 5).

Figura 3. Células linfoides atípicas (flecha) en el aspirado vítreo de un paciente con linfoma.
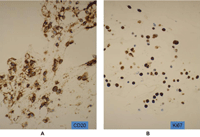
Figura 4. Aspirado vítreo. Tinción de CD20+ (A) y Ki67 (B) en un paciente con linfoma retiniano B con alto grado de proliferación.
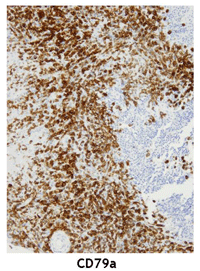
Figura 5. Biopsia retiniana en la cual con tinción específica (CD79a) se observan células linfoides.
La elevación de la interleucina 10 (IL-10) en el fluido ocular o una proporción IL-10:IL-6 >1 son altamente indicativas de LPVR de células B, pero no diagnóstica. Por tanto, la elevación de la IL-10 como único biomarcador para el diagnóstico del LPVR no debe llevarse a cabo si no hay ninguna evidencia de enfermedad9. Los valores de IL-10 en ell humor acuoso se han relacionado con la respuesta clínica a la quimioterapia local, y podrían utilizarse como un biomarcador para el LPVR.
Pruebas diagnósticas
Las pruebas de imagen oftalmológicas pueden ser útiles para el diagnóstico del LPVR. La angiografía con fluoresceína muestra lesiones hiperfluorescentes de tamaño variable que suelen ser más numerosas que las visibles por oftalmoscopia. También puede presentarse como un moteado o parcheado difuso del epitelio pigmentario de la retina (EPR)10,11. Las imágenes de tomografía de coherencia óptica pueden mostrar nódulos hiperreflectantes en el EPR (Figuras 6A y 6B)10, lo que probablemente corresponde a células linfomatosas subretinianas entre el EPR y la membrana de Bruch. En la autofluorescencia pueden observarse múltiples manchas hipoautofluorescentes, lo cual sugiere una superposición de las células del LPVR sobre las células del EPR, o atrofia del EPR12.
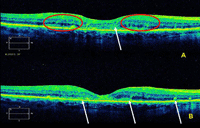
Figura 6. Tomografía de coherencia óptica. Se observa infiltración del EPR y membrana de Bruch en un paciente con linfoma retiniano A y B.
Dada la posibilidad de afectación del SNC en el momento del diagnóstico, es esencial realizar una resonancia magnética craneal con contraste y una evaluación del líquido cefalorraquídeo para valorar la existencia de lesiones en el SNC (Figura 7).
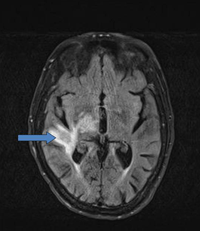
Figura 7. Imagen de resonancia magnética de un linfoma cerebral.
Diagnóstico diferencial
Como ya se ha reseñado con anterioridad, el diagnóstico diferencial debe incluir los síndromes white dot, las lesiones granulomatosas y las retinitis necrotizantes (citomegalovirus, herpes, toxoplasmosis y sífilis). El aspecto oftalmoscoscópico, la historia clínica del paciente y las pruebas de imagen y de laboratorio son de gran ayuda para efectuar el diagnóstico diferencial.Tratamiento
Para tratar a los pacientes con LPVR se recomiendan las siguientes pautas:- Sin afectación del SNC: el objetivo del tratamiento debe ser erradicar enfermedad del ojo y prevenir su diseminación al SNC. Si la afectación es unilateral puede utilizarse terapia local con inyecciones de metotrexato/rituximab intravítreo, radioterapia externa (30-35 Gy) o ambas. Si ambos ojos están afectados, se administrará quimioterapia sistémica con un único fármaco (metotrexato) o una combinación (ARA-C) junto con tratamiento intravítreo con metotrexato/rituximab13,14.
- Con afectación del SNC: altas dosis de quimioterapia sistémica (metotrexato, rituximab) e intratecal junto con radioterapia holocraneal y ocular. En los pacientes de edad avanzada hay que tener en cuenta que la radioterapia holocraneal puede provocar leucoencefalopatía y procesos de demencia.
Bibliografía
- Chan CC, González JA. Primary Intraocular Lymphoma. New Jersey, London, Singapore, Beijing, Shanghai, Hong Kong, Taipei: Chennai World Scientific Publishing Co. Pte. Ltd.; 2007. p. 1-267.
- National Cancer Institute. Surveillance, Epidemiology, and End Results. Fast Stats: Statistics Stratified by Cancer Site. Disponible en: http://www.seer.cancer.gov/faststats/selections.php?series cancer. Accessed May 8, 2011.
- Hong JT, Chae JB, Lee JY, et al. Ocular involvement in patients with primary CNS lymphoma. J Neurooncol. 2011;102:139-45.
- Coupland SE, Heimann H, Bechrakis NE. Primary intraocular lymphoma: a review of the clinical, histopathological and molecular biological features. Graefes Arch Clin Exp Ophthalmol. 2004;242:901-13.
- Mochizuki M, Singh AD. Epidemiology and clinical features of intraocular lymphoma. OculIm munol Inflamm. 2009;17:69-72.
- Chan CC, Rubenstein JL, Coupland SE, Davis JL, Harbour JW, Johnston PB, et al. Primary vitreoretinal lymphoma: a report from an International Primary Central Nervous System Lymphoma Collaborative Group symposium. Oncologist. 2011;16(11):1589-99. doi: 10.1634/theoncologist.2011-0210. Epub 2011 Nov 1.
- Gonzales JA, Chan CC. Biopsy techniques and yields in diagnosing primary intraocular lymphoma. Int Ophthalmol. 2007;27:241-50.
- Davis JL, Solomon D, Nussenblatt RB, et al. Immunocytochemical staining of vitreous cells. Indications, techniques, and results. Ophthalmology. 1992;99:250-6.
- Cassoux N, Giron A, Bodaghi B, et al. IL-10 measurement in aqueous humor for screening patients with suspicion of primary intraocular lymphoma. Invest Ophthalmol Vis Sci. 2007; 48:3253-9.
- Fardeau C, Lee CP, Merle-Béral H, et al. Retinal fluorescein, indocyanine green angiography, and optic coherence tomography in non-Hodgkin’s primary intraocular lymphoma. Am J Ophthalmol. 2009;147:886-94.
- Velez G, Chan CC, Csaky KG. Fluorescein angiographic findings in primary intraocular lymphoma. Retina. 2002;22:37-43.
- Ishida T, Ohno-Matsui K, Kaneko Y, et al. Fundus autofluorescence patterns in eyes with primary intraocular lymphoma. Retina. 2010;30:23-32.
- Giuliari GP, Hinkle DM, Foster CS. Local treatment for lymphoid malignancies of the eye. Anticancer Agents Med Chem. 2009;9:1123-8.
- Pe’er J, Hochberg FH, Foster CS. Clinical review: treatment of vitreoretinal lymphoma. Ocul Immunol Inflamm. 2009;17:299-306.