Volumen 21 - Número 5 - Diciembre 2013
Hemangioma de coroides
J. Elizalde
Unidad de Oncología Ocular. Centro de Oftalmología Barraquer.
Barcelona
Barcelona
CORRESPONDENCIA
Javier Elizalde
E-mail: javierelizalde@barraquer.com
E-mail: javierelizalde@barraquer.com
Hemangioma circunscrito
El tumor vascular más frecuente de la úvea posterior es el hemangioma circunscrito. Histopatológicamente se trata de un tumor ovoide formado por grandes canales y cavidades vasculares separadas por finos septos. Su incidencia es baja; se estima una proporción de un hemangioma circunscrito por cada 15 a 40 casos de melanoma de coroides. Afecta con la misma frecuencia a hombres y mujeres, y la mayoría de los casos se diagnostican entre la cuarta y la sexta décadas de la vida1.Clínica
Se presenta como una lesión coroidea sobreelevada, anaranjada, unilateral, solitaria y sin asociación sistémica. Sus márgenes suelen estar bien delimitados y se localiza típicamente en la región retroecuatorial (en la mácula, por debajo de las arcadas vasculares temporales o bien yuxtapapilar) (Figura 1). Puede ser asintomático, inducir una hipermetropización (en caso de que se sitúe en la mácula) o bien cursar con visión borrosa si el tumor exuda y produce desprendimiento de retina. La alteración crónica del epitelio pigmentado de la retina (EPR) suprayacente a la tumoración puede justificar la presencia de depósitos granulados o de signos de metaplasia del EPR1,2. En otros casos, de larga evolución, también puede producirse una degeneración quística intrarretiniana. El hemangioma coroideo muy rara vez se complica con neovascularización subretiniana.

Figura 1. Hemangioma de coroides circunscrito, temporal inferior a la fóvea.
Diagnóstico
El diagnóstico se realiza fundamentalmente por la apariencia oftalmoscópica del tumor y por su localización. La coloración anaranjada de la lesión es muy característica y permite realizar el diagnóstico diferencial con otras masas coroideas, como el melanoma o las metástasis.En la ecografía el hemangioma se observa como una masa sólida en modo B (brillo) y muestra una alta reflectividad en modo A (amplitud) (Figura 2).
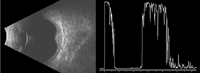
Figura 2. Ecografías en modos A y B de un hemangioma de coroides. En la imagen de la izquierda se aprecia una tumoración sólida y en modo A una señal de hiperreflectividad mantenida.
La angiografía fluoresceínica no revela hallazgos patognomónicos. En la fase precoz se observa una hiperfluorescencia reticular irregular, correspondiente al relleno de los grandes vasos coroideos. Esta hiperfluorescencia va aumentando con el tiempo a medida que el contraste alcanza el espacio intratumoral, y difunde también al espacio intrarretiniano. La angiografía con verde de indocianina sí resulta muy útil para confirmar el diagnóstico y diferenciarlo de otros tumores coroideos. En las fases precoces se evidencia el relleno de los vasos nutricios de la tumoración. Esta hiperfluorescencia aumenta de intensidad con rapidez (flash coroideo). En fases tardías aparece una hipofluorescencia característica de la tumoración, conocida como fenómeno de lavado (washout)1-6 (Figura 3).

Figura 3. Hemangioma de coroides con fluido subretiniano asociado. Flash coroideo (hiperfluorescencia) inicial en el verde de indocianina y fenómeno de lavado en tiempos tardíos.
La tomografía de coherencia óptica permite evidenciar alteraciones retinianas secundarias al tumor, como una distorsión de la arquitectura retiniana, con rectificación de la línea del EPR por el efecto masa y engrosamiento retiniano suprayacente, un desprendimiento de retina exudativo incipiente o una degeneración quística intrarretiniana. También resulta muy útil para la monitorización objetiva de la respuesta al tratamiento7 (Figura 4).
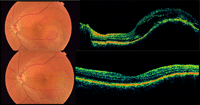
Figura 4. Hemangioma de coroides antes y después del tratamiento con terapia fotodinámica.
Tratamiento
Frente a un hemangioma de coroides asintomático, no asociado a fluido subretiniano, es aconsejable mantener una conducta expectante, realizando controles oculares periódicos. Aunque se trata de un tumor benigno, existe el riesgo de que evolucione hacia un desprendimiento de retina exudativo.La opción terapéutica de elección para el hemangioma de coroides circunscrito sintomático es la terapia fotodinámica. Esta técnica induce una trombosis de la red vascular tumoral con mínimo daño sobre la retina neurosensorial adyacente, lo cual permite tratar eficazmente lesiones muy próximas a la fóvea8,9. Los parámetros utilizados son los mismos que se emplean en el tratamiento de las membranas neovasculares. La terapia consta de dos fases: en la primera se realiza una infusión intravenosa de verteporfina (Visudyne®) durante 10 minutos a una dosis de 6mg/m2 de superficie corporal, diluida en 30ml de solución para infusión. En la segunda fase se realiza la activación lumínica 15 minutos después del comienzo de la infusión. Con una intensidad lumínica de 600mW/cm2 se requieren 83 segundos para suministrar la dosis estipulada de 50 J/cm2. La lesión debe englobarse por completo, ya sea con un único impacto o bien con varias aplicaciones no confluentes. En la mayoría de los casos,con una única sesión se consigue la resolución del fluido subretiniano y una reducción marcada o casi completa del tumor (Figura 4). En ocasiones es necesario repetir el tratamiento con una periodicidad que varía de 3 a 5 meses según los autores, antes de conseguir el control definitivo de la tumoración10,11. El tratamiento oral con propranolol también ha demostrado su eficacia en casos aislados12.
La radioterapia, en sus modalidades de braquiterapia epiescleral o bien de radioterapia externa (clásica, estereotáxica o bien teleterapia con protones), constituye una buena opción para el tratamiento de los hemangiomas coroideos muy prominentes, con desprendimiento de retina extenso, así como para los hemangiomas refractarios a otros tratamientos. La radioterapia es efectiva para inducir la reabsorción del fluido subretiniano y para destruir el tumor, pero también puede conllevar efectos colaterales sobre la retina y el nervio óptico3,7.
Hemangioma difuso
El hemangioma difuso de coroides es, desde el punto de vista histopatológico, similar al hemangioma circunscrito. Sin embargo, su tamaño es mayor y clínicamente sus límites están peor definidos. Con frecuencia se asocia a alteraciones sistémicas formando parte de la hemangiomatosis encefalofacial o síndrome de Sturge-Weber (sea o no completo), o bien de ciertas formas de síndrome de Klippel-Trenaunay. Su incidencia es notablemente inferior a la del hemangioma circunscrito, con una proporción aproximada de 1/10. A diferencia de otras facomatosis, su patrón hereditario no está bien establecido3,4.Clínica
El síndrome de Sturge-Weber se caracteriza por la presencia de al menos dos de las siguientes anomalías: hemangioma facial (nevus flammeus), hemangioma intracraneal homolateral, hemangioma coroideo difuso homolateral, anomalías vasculares conjuntivales y epiesclerales homolaterales, y glaucoma.El hemangioma difuso de coroides aparece aproximadamente en un 50% de los pacientes con síndrome de Sturge Weber y en un 40% de los que presentan nevus flammeus o hemangioma facial. En general la tumoración coroidea es unilateral y homolateral al hemangioma facial. Se presenta como una lesión de color rojo anaranjado, de gran tamaño, localizada en el polo posterior con extensión hacia la región preecuatorial, que da lugar a una coloración del fondo de ojo denominada en “tomate ketchup”. Su espesor suele ser mayor en el área macular con los bordes mal definidos, a menudo muy difíciles de diferenciar de la coroides sana. En la ecografía en modo B aparece una masa difusa con solidez acústica en la coroides posterior, con su característico patrón de alta reflectividad en modo A. Otros signos a menudo asociados son la degeneración quística de la retina suprayacente, la dilatación y la tortuosidad de los vasos retinianos, y alteraciones en el EPR. Además, el hemangioma difuso de coroides puede complicarse con un desprendimiento exudativo de la retina, glaucoma neovascular y catarata secundaria. Si el hemangioma no cursa con desprendimiento de retina, puede pasar desapercibido en la exploración oftalmoscópica. El estudio comparativo de la coloración del fondo de ojo afecto con el ojo contralateral sano es un buen método para sospechar el diagnóstico4,5 (Figura 5).

Figura 5. Nevus flammeus y hemangioma difuso de coroides homolateral. Obsérvese la coloración intensa del fondo del ojo afecto.
Tratamiento
Los tumores localizados en el área foveal inducen una hipermetropización a muy temprana edad, por lo que está indicada la corrección con lentes esféricas positivas para evitar la ambliopía, y realizar un seguimiento periódico.La evolución natural del hemangioma difuso de coroides suele comportar un mal pronóstico, por su gran tendencia al desprendimiento de retina exudativo. Dado que se trata de una tumoración radiosensible, en la actualidad se acepta universalmente la radioterapia como tratamiento de elección. Los resultados obtenidos con braquiterapia epiescleral (utilizando aplicadores de grandes dimensiones y una dosis de 40G y en el ápex del tumor), teleterapia circunscrita con protones acelerados (18 a 20 G y repartidos en cuatro fracciones) y teleterapia global o estereotáxica con fotones (20 a 30 Gy repartidos en 10 a 15 fracciones) son equiparables3,13. La reabsorción del fluido subretiniano suele producirse en 3 a 6 meses después del tratamiento, con una reducción progresiva del tamaño de la tumoración.
El tratamiento del glaucoma que puede asociarse al síndrome de Sturge-Weber comporta ciertas peculiaridades y dificultades, pues en presencia de un hemangioma difuso de lacoroides hay más riesgo de hemorragia expulsiva intraoperatoria, y la hipotonía ocular postoperatoria puede provocar una efusión uveal masiva. Las opciones terapéuticas incluyen el tratamiento clásico (trabeculectomía) y los dispositivos valvulares de drenaje.
Bibliografía
- Shields CL, Honavar SG, Shields JA, et al. Circumscribed choroidal hemangioma: clinical manifestations and factors predictive of visual outcome in 200 consecutive cases. Ophthalmology. 2001;108:2237-48. Erratum in: Ophthalmology. 2002;109:222.
- Mashayeky A, Shields CL. Circumscribed choroidal hemangioma. Review. Curr Opin Ophthalmol. 2003;14:142-9.
- Zografos L. Tumeurs vasculaires de l’uvée. En: Tumeurs intraoculaires. Paris: Societé Française d´Ophtalmologie. Edt Masson; 2006.p. 315-34.
- Singh AD, Kaiser PK. Uveal vascular tumors. En: Singh AD, Damato B, Pe’er J, et al., eds. Clinical Ophthalmic Oncology. Philadelphia: Saunders Elsevier; 2007. p. 289-99.
- Shields JA, Shields CL. Vascular tumors and malformations of the uvea. En: Intraocular tumors. An Atlas and Textbook. 2nd ed. Philadelphia:Lippincott Williams & Wilkins; 2008. p. 229-62.
- Arévalo JF, Shields CL, Shields JA, et al. Circumscribed choroidal hemangioma: characteristic features with indocyanine green videoangiography. Ophthalmology. 2000;107:344-50.
- Shields CL, Materin MA, Shields JA, et al. Review of optical coherence tomography for intraocular tumors. Curr Opin Ophthalmol. 2005;16:141-54.
- Barbazetto I, Schmidt-Erfurth U. Photodynamic therapy of choroidal hemangioma: two case reports. Graefes Arch Clin Exp Ophthalmol. 2000;238:214-21.
- Madreperla SA. Choroidal hemangioma treated with photodynamic therapy using verteporfin. Arch Ophthalmol. 2001;119:1606-10.
- Boixadera A, García-Arumí J, Martínez Castillo V, Encinas JL, Elizalde J, Blanco Mateos G, et al. Prospective clinical trial evaluating the efficacy of photodynamic therapy for symptomatic circumscribed choroidal hemangioma. Ophthalmology. 2009;116:100-5.
- Elizalde J, Vasquez LM, Iyo F, Abengoechea S. Photodynamic therapy in the management of circumscribed choroidal hemangioma. Can J Ophthalmol. 2012; 47(1):16-20.
- Sanz-Marco E, Gallego R, Díaz-Llopis M. Oral propranolol for circumscribed choroidal hemangioma. Case Rep Ophthalmol. 2011;2(1):84-90.
- Kivëla T, Tenhunen M, Joensuu T, et al. Stereotactic radiotherapy of symptomatic circumscribed choroidal hemangiomas. Ophthalmology. 2003;110:1977-82.