1Unidad Investigación Oftalmológica “Santiago Grisolía”. Valencia
2Hospital Universitario Dr. Peset. Valencia
3Facultad de Medicina y Odontología. Universidad de Valencia
4Centro de Estudios Oftalmológicos de Valencia (CEOVA). Valencia
5Hospital Arnau de Vilanova. Valencia
6Clínica Rahhal. Valencia
7Hospital General de Castellòn de la Plana. Castellòn
8Hospital Universitario y Politécnico La Fe. Valencia
9Hospital de Vinaroz. Vinaroz (Castellón)
10Hospital de Sagunto. Sagunto (Valencia)
CORRESPONDENCIA
Unidad Investigación Oftalmológica “Santiago Grisolía”
Avenida Gaspar Aguilar 90. 46017 Valencia
E-mail: dolores.pinazo@uv.es
www.unidadinvestigacionoftalmologica.es
Introducción
La retinopatía diabética (RD) es una microangiopatía responsable de la disminución de visión y de la ceguera legal en jóvenes e individuos de mediana edad, ya que a partir de los 15 años de sufrir la enfermedad diabética el riesgo de ceguera es 25 veces mayor en estos pacientes que en la población no diabética1. Por su morbilidad, la RD es además causa de pérdida de horas laborales y minusvalías, y conlleva una gran demanda asistencial tanto médica como quirúrgica2. Se estima que casi todos los pacientes con DM tipo 1 desarrollarán la RD. Alrededor del 80% de diabéticos tipo 2 y aproximadamente la mitad de los diabéticos no insulino-dependientes también desarrollaran la RD en el curso de su enfermedad, en algún punto del periodo comprendido entre el diagnóstico y los 20 años de evolución3. Se consideran factores responsables de la aparición de la RD, la duración de la enfermedad diabética, el aumento crónico de la glucemia determinado mediante la hemoglobina glicosilada, la hipertensión arterial y afectación cardiovascular subyacente.Los principales grupos internacionales de estudio sobre la evolución y el tratamiento de la RD aparecieron entre las décadas de los 60 y los 90, y son el Diabetic Retinopathy Study (DRS)4, el Early Treatment Diabetic Retinopathy Study (ETDRS)5, el Diabetic Retinopathy Vitrectomy Study (DRVS)6 y el Diabetes Control and Complications Trial (DCCT)7. Todos ellos contribuyeron a mejorar el pronóstico de los pacientes afectos, sentando las bases para el diagnóstico y tratamiento de la RD en todo el mundo.
Aunque sigue sin conocerse la causa de la RD, entre los mecanismos más probables se encuentra sin duda la hiperglucemia como inductora de los cambios metabólicos intracelulares que resultan a su vez en un aumento del sorbitol que provoca el engrosamiento de la membrana basal endotelial y pérdida de pericitos. Esta pérdida tiene como consecuencia la rotura de la barrera hemato-retiniana, filtración al espacio extravascular con la formación del edema y de exudados duros formados por lipoproteínas, aparición de los microaneurismas por alteración estructural de la pared vascular, activación de los factores derivados del éstasis vascular en los microaneurismas, y disminución de la luz capilar. Todo conducirá a la isquemia retiniana y aparición de exudados algodonosos como manifestación de los infartos de la capa de fibras nerviosas, así como la liberación de factores en respuesta a la isquemia tales como el factor soluble estimulador del crecimiento del endotelio vascular (Vascular endothelial growth factor; VEGF) y sus efectos sinérgicos junto al factor de crecimiento fibroblástico básico (basic fibroblast growth factor; bFGF) lo que conlleva la: neovascularización (y formación de hemorragias) y fibroproliferación (con la presencia de tracciones vítreo-retinianas y desprendimiento de retina)8,9.
Desde el punto de vista patogénico, la DM se considera una enfermedad multifactorial, de ahí su complejidad, pero también por ello existe la posibilidad de abordarla desde distintos puntos4-7,10-13. Todos los avances en biomedicina y biotecnología de los últimos años todavía no han permitido esclarecer las bases celulares y moleculares que influyen sobre la aparición y el avance de las complicaciones oculares.
De acuerdo con el Early Treatment Diabetic Retinopathy Study (ETDRS)5 que clasifica la RD en razón de la severidad, identificamos las siguientes fases:
- No RD aparente.
- RD no proliferativa leve.
- RD no proliferativa moderada.
- RD no proliferativa grave.
- RD proliferativa (complicaciones fibroproliferación/ vasoproliferación).
La RDP se subdivide a su vez en precoz, de alto riesgo y avanzada. El Edema Macular puede acontecer en cualquier momento de la progresión de la RD, y aunque no se contempla en esta clasificación, el grupo de estudio la recoge de una forma separada.
La evidencia científica indica que el estrés oxidativo (EOx), desequilibrio de fuerzas pro-oxidantes y antioxidantes a favor de la oxidación, está implicado en el inicio y curso de la RD14-17. Además los ácidos grasos poliinsaturados omega 3 ejercen funciones anti-inflamatorias y anti-angiogénicas, pero no pueden ser sintetizados por el organismo, por lo que su disponibilidad puede también influir en el desarrollo de la RD18-20. Otras moléculas que se consideran ya responsables de algunos de los efectos inflamatorios y anomalías vasculares que se pueden apreciar en el curso de la RD son la homocisteína, un marcador de enfermedad vascular21 y la proteína C reactiva22, un marcador potente de inflamación y de insulino-resistencia que si aumenta puede ayudar a predecir el síndrome de resistencia a la insulina (con o sin intolerancia a los carbohidratos), el desarrollo de la diabetes tipo 2 y de enfermedad cardiovascular.
Presentamos los primeros resultados de un estudio multicéntrico llevado a cabo en 10 centros de la Comunidad Valenciana y con un total de 28 investigadores para analizar los mecanismos celulares y moleculares de pacientes con RD, en un seguimiento a 3 años que se denomina: “Estudio Valencia Sobre Retinopatía Diabética” (EVRD). Se integra información general de los pacientes y sus familias, datos antropométricos, estilo de vida, exploración oftalmológica, análisis bioquímicos clásicos y análisis de las moléculas específicas para evaluar el estrés oxidativo, inflamación y riesgo vascular, con el fin de aportar los resultados al conocimiento de esta enfermedad y su posible traslación a la clínica oftalmológica.
Material y métodos
Características de la puesta en marca del estudio
Los 10 centros participantes firmaron el consentimiento para realizar el estudio y se obtuvieron los permisos de los CEICs así como de los jefes de servicio y coordinadores de los propios centros para avanzar en el cronograma planteado. Tras establecer la muestra necesaria de participantes, que de acuerdo con el programa EPIDAT 6.0 se fijó en 350 sujetos, y ajustar la selección de los participantes a los criterios de inclusión/exclusión de los mismos (que se enumeran a continuación), comenzó la pre-selección inicial de participantes por cada investigador, que se llevó a cabo entre los meses de Julio a Diciembre de 2012 obteniendo un total de 512 individuos entre los que se estimaba disponer del número óptimo para el inicio y desarrollo del estudio.Criterios de inclusión para pacientes con diabetes mellitus 1 o 2
- >25 años y < 80 años.
- Padecer diabetes mellitus 1 y 2.
- El estadio de retinopatía diabética debe ser inicial.
- Capacidad para entender el estudio y colaborar.
- Firmar consentimiento.
Criterios de exclusión para pacientes con diabetes mellitus 1 o 2
- < 25 años y > 80 años.
- No ser diabéticos.
- Padecer cualquier otra enfermedad ocular que interfiera en la clasificación y obtención de los distintos resultados.
- Estadio de la retinopatía diabética avanzado.
- Sin capacidad para entender el estudio ni colaborar.
- Trastorno a nivel nutricional.
- Tomar vitaminas.
- Padecer otra patología a nivel sistémico que pueda afectar a los resultados por su propio padecimiento o por su tratamiento (afección grave del sistema cardiovascular, patología onco-hematológica…).
Criterios de inclusión para pacientes controles
- >25 años y < 80 años.
- Individuos sanos que no padezcan enfermedad sistémica o tratamiento que pueda interferir en los resultados (afecciones graves del sistema cardiovascular, patología onco-hematológica)
- Capacidad para entender el estudio y colaborar.
- Firmar consentimiento.
Criterios de exclusión para pacientes controles
- < 25 años y > 80 años.
- Cualquier enfermedad ocular que interfiera en la clasificación y obtención de los distintos resultados.
- Sin capacidad para entender el estudio, ni colaborar.
- Trastorno nutricional.
- Tomar vitaminas.
- Padecer enfermedad sistémica o tratamiento que pueda interferir en los resultados (afecciones graves del sistema cardiovascular, patología onco-hematológica).
Descripción de la metodología
Todos los participantes fueron citados en los días programados para ser recibidos por los investigadores de cada centro. Se les realizó entrevista personal y examen oftalmológico. Además se extrajo sangre de la vena antecubital en condiciones de ayuno que se procesó para las determinaciones bioquímicas clásicas y se extrajeron dos tubos más que fueron destinados al análisis de las moléculas emergentes y moléculas relacionadas con estrés oxidativo. Todos los datos se registraron en una hoja Excel.- Datos demográficos: Nombre y apellidos, teléfono de contacto, historia clínica y/o SIP, sexo, edad, lugar de nacimiento, lugar de residencia actual
- Características personales y familiares: Estado civil. Numero de hijos. Profesión o carrera profesional. Situación laboral actual. Peso. Talla. Enfermedades anteriores de interés. Enfermedad diabética (inicio/duración en años/tipo de diabetes/medicación desde cuando y qué tipo). Enfermedad cardiovascular y/o hipertensión arterial. Antecedentes familiares de diabetes, hipertensión o cardiopatía. Otras enfermedades presentes.
- Hábitos y estilo de vida: Beber. Fumar. Vida activa o Sedentaria. Ejercicio diario o esporádico. Nutrición (tipo de nutrición, dieta, cuestionario dieta mediterránea).
- Datos antropométricos: Peso, Talla. Índice de masa corporal
- Exploración oftalmológica: AV, Biomicroscopía, PIO, Retinografía, OCT
- Análisis bioquímicos clásicos: Hemograma y recuento leucocitario, VSG, Hb., Hto., Hb Glicosilada (HbA1c), Colesterol total (HDL, LDL), Triglicéridos.
- Análisis bioquímicos emergentes: PCR, Homocisteína.
- Análisis redox: Actividad pro-oxidante (MDA), Actividad antioxidante total (AOXT).
Resultados
La edad media de los participantes sanos fue de 53±12 años frente a 39±11 años de los DM1 y de 60±10 años en el DM2. En razón de género las proporciones fueron de 47% mujeres y 53% varones en el GC, de 51% mujeres y 49% varones en el DM1 y de 59% mujeres y 41% varones en el DM2. Las principales características de los participantes en el estudio se muestran en la Tabla 1.

Tabla 1. Principales características de los participantes en el estudio
Así se comprobó que el porcentaje de participantes con DM1 y antecedentes familiares de diabetes (DM) y enfermedad cardiovascular (CDV) era superior al de los controles. El porcentaje de pacientes diabéticos que presentaban una nutrición normal según la entrevista nutricional era menor que en los controles. Sin embargo la motivación de los diabéticos para realizar ejercicio físico era superior a la de los controles, pero el índice de masa corporal demostraba que era mayor en los diabéticos que en los participantes controles. Además, nuestros datos aportaron un dato interesante, que los diabéticos tipo 1 fumaban más que los participantes sanos, pero bebían menos que éstos.
Los análisis de las muestras de sangre de los participantes demostraron diferencias entre grupos (Tabla 2). Los parámetros bioquímicos relacionados con la diabetes mellitus y su control médico (Glucemia basal y Hemoglobina glicosilada) tal como era de esperar aumentaron significativamente en los diabéticos de ambos tipos respecto a los pacientes sanos. Los pacientes con DM1 presentaron aparentemente un mejor control de la lipemia, pero aumentaron los valores de homocisteína y de la proteína C reactiva, con respecto a los participantes sanos.
En cuanto al estado oxidativo/antioxidante, se apreció la elevación de actividad oxidativa (p<0,01) y la disminución muy significativa de la capacidad antioxidante total (p<0,001).
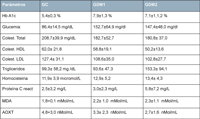
Tabla 2. Bioquímica de los participantes en el estudio.
No se apreciaron cambios relevantes en cuanto a los parámetros clínicos obtenidos de los 3 grupos de participantes (Tabla 3). El 14% de los pacientes con DM1 presentaron RD no proliferativa leve en uno u ambos ojos. Nadie padecía edema macular y las medidas de la OCT en el cuadrante supero-temporal en ambos ojos eran normales. Lo mismo que ocurrió con estos pacientes, también en los diabéticos tipo 2 aumentaron los parámetros relacionados con el control de la enfermedad diabética frente a los sujetos no diabéticos (controles). Además presentaron aparentemente un mayor control del colesterol, pero aumentaron los triglicéridos, la homocisteína y la proteína C reactiva.
La visión fue algo menor en este grupo que en los participantes sanos, y la presión intraocular era similar en todos los participantes. En el examen del fondo de ojo se apreció que un 10% de pacientes diabéticos tipo 2 tenía RD no proliferativa leve y un 4% RD no proliferativa moderada. Se identificó edema macular focal en un 4% de pacientes DM2 y difuso en 1% de pacientes. La media de os parámetros de la OCT no mostró diferencias significativas entre grupos.
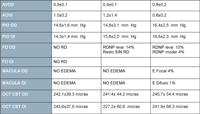
Tabla 3. Examen oftalmológico de los grupos de estudio.
Discusión
La Obesidad y la Diabetes Mellitus tipo 2 fueron declaradas por la Organización Mundial de la Salud (OMS) como las pandemias del siglo XXI en los países industrializados. Además, el síndrome de resistencia a la insulina, con una elevada prevalencia en la población, está íntimamente relacionado con estos procesos1,8,11,23,24. En nuestro grupo de estudio, el índice de masa corporal fue significativamente superior en el grupo DM tipo 2.Además, se han descrito concentraciones elevadas de proteína C reactiva ultrasensible en obesos, posiblemente debido a que mantienen un estado metabólico muy particular, con aumento de citoquinas particularmente la IL-6 (producida en los adipocitos) y que activa la síntesis de proteína C reactiva en el hígado22. Por otro lado, en los casos de intolerancia a los hidratos de carbono, y en la Diabetes Mellitus tipo 2 también se asocia un estado inflamatorio crónico pudiendo elevar también los niveles de la proteína C reactiva24,25. Y también está demostrado que el estado inflamatorio de la pared vascular es un factor común en la etiopatogenia de estas patologías. Esto coincide con los resultados de este estudio, en los que se evidencia un aumento de los niveles de proteína C reactiva ultrasensible principalmente en los diabéticos tipo 2.
La metionina se encuentra en las proteínas y normalmente se degrada en homocisteína y, después, en cisteína26. La homocisteína posee acciones citotóxicas, de manera que puede llegar a lesionar los vasos sanguíneos provocando anomalías en las células del endotelio vascular y alteraciones de la matriz extracelular, con tendencia a formación de coágulos21,27. En el presente estudio demostramos la importancia de los valores de homocisteína plasmática en los diabéticos, ya que en ambos tipos estaba significativamente aumentada.
Y en relación al estrés oxidativo, diversos investigadores consideran que desempeña una función importante en el desarrollo de la diabetes ya que interfiere en la señalización de la insulina y el transporte de glucosa en las células14-17. De hecho los pacientes que presentaban estrés oxidativo tenían mayor resistencia a la insulina que los pacientes que no la tenían. La disminución significativa de la actividad antioxidante que muestran los diabéticos de este estudio coincide de forma esencial con estas descripciones.
Lo más importante es prevenir la enfermedad diabética en lo posible para evitar las complicaciones oculares y la pérdida de visión, favoreciendo un estilo de vida saludable, específicamente la pérdida moderada de peso y el incremento de la actividad física. Las moléculas identificadas en este estudio como biomarcadoras de estrés oxidativo (malonildialdehido y antioxidante total), inflamación (proteína C reactiva) y riesgo vascular (homocisteína) en relación a la retinopatía diabética, pueden ayudar a mejorar el pronóstico visual de los diabéticos. En los años sucesivos, el estudio aportará datos más valiosos sustentados en el seguimiento de estos pacientes.
Investigadores EVRD
Vicente Vila, Pedro Sanz, Fernando Santander, Manuel Diaz-Llópis, Roberto Gallego-Pinazo, Rosa Dolz, Sebastián Martínez, Maria Andreu, Juan Marín, Vicente Chaqués, Ana Llorca, Maria Villalonga, Maria LLedó Redón, Maria J. Roig, Mara Albert, Luis Alonso, M. S. Rahhal, M. Fernanda García Esparza, Antonio Lleó, Oscar Alvarez Barrachina, Sheila Pons-Vázquez, Carmina Galbis Estrada, Bárbara Vivar, Kian Shoaie-Nia, Laura Puchades, Carla Marco-Ramírez, Vicente Zanón-Moreno, y Maria D. Pinazo-Durán.Este estudio se financia en parte por la donación de Laboratorios THEA, Barcelona (España) y por la Asociación de Oftalmólogos e Investigadores en Oftalmología de Valencia (AOFINV). Todos los oftalmólogos trabajan en el estudio de forma voluntaria y no perciben remuneración por su trabajo. Los participantes en el estudio tampoco perciben remuneración por su contribución voluntaria en este estudio, lo que quedó estipulado por las partes desde el comienzo del trabajo.
Bibliografía
- Palmberg PF. Diabetic retinopathy. Diabetes. 1977;26:703-9.
- Klein R, Klein BE, Moss SE, Davis MD, DeMets DL. The Wisconsin Epidemiologic Study of Diabetic retinopathy III. Prevalence and risk of diabetic retinopathy when age at diagnosis is 30 or more years. Arch Ophthamol. 1984;102:527-32.
- Dahl-Jorgensen K, et al. Rapid tightening of blood glucose control leads to transient deteroration of retinopathy in insulin dependent diabetes mellitus. The Oslo Sudy. Br Medical Journal. 1985;290:811-5.
- Photocoagulation Treatment of Proliferative Diabetic Retinopathy. Clinical Application of Diabetic Retinopathy Study (DRS) Findings, DRS Report Number 8. The Diabetic Retinopathy Study Research Group. Ophthalmology. 1981;88:583-600
- Fundus photographic risk factors for progression of diabetic retinopathy. ETDRS report number 12. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology. 1991;98:823-33
- Early vitrectomy for severe vitreous hemorrhage in diabetic retinopathy. Four-year results of a randomized trial: Diabetic Retinopathy Vitrectomy Study Report 5. Arch Ophthalmol. 1990;108:958-64.
- Progression of Retinopathy with Intensive versus Conventional Treatment in the Diabetes Control and Complications Trial. Ophthalmology. 1995;102:647-61.
- Simó R, Hernández C, Advances in the Medical Treatment of Diabetic Retinopathy. Diabetes Care. 2009;32(8):1556–62.
- Sanabria Ruiz-Colmenares MR, Pastor Jimeno JC, Garrote Adrados JA, Telleria Orriols JJ, Yugueros Fernández MI. Cytokine gene polymorphisms in retinal detachment patients with and without proliferative vitreoretinopathy: a preliminary study. Acta Ophthalmol. Scand 2006; 84:309-313
- Friedman EA. Advanced glycosylated end products and hyperglycemia in the patogénesis of diabetic complications. Diabetes Care. 1999;22(supl2):B65-71.
- Brownlee M. Biochemistry and molecular cell biology of diabetic complications. Nature. 2001;414(13:813-20.
- Antcliff, RJ. The pathogenesis of edema in diabetic maculopathy. Semin Ophthalmol. 1999;14:223-232.
- Arevalo JF, Lasave AF, Wu L, Diaz-Llopis M, Gallego-Pinazo R, Alezzandrini AA, et al. Pan-American Collaborative Retina Study Group (PACORES). Intravitreal bevacizumab plus grid laser photocoagulation or intravitreal bevacizumab or grid laser photocoagulation for diffuse diabetic macular edema: results of the Pan-american Collaborative Retina Study Group at 24 months. Retina. 2013 Feb;33(2):403-41.
- El-Bab MF, Zaki NS, Mojaddidi MA, Al-Barry M, El-Beshbishy HA.Diabetic retinopathy is associated with oxidative stress and mitigation of gene expression of antioxidant enzymes. Int J Gen Med. 2013;6:799-806.
- Silva KC, Rosales MA, Hamassaki DE, Saito KC, Faria AM, Ribeiro PA, et al. Green tea is neuroprotective in diabetic retinopathy. Invest Ophthalmol Vis Sci. 2013;54:1325-36.
- Mancino R, Di Pierro D, Varesi C, Cerulli A, Feraco A, Cedrone C, et al. Lipid peroxidation and total antioxidant capacity in vitreous, aqueous humor, and blood samples from patients with diabetic retinopathy. Mol Vis. 2011;17:1298-304.
- Garcia-Medina JJ, Pinazo-Duran MD, Garcia-Medina M, Zanon-Moreno V, Pons-Vazquez S. A 5-year follow-up of antioxidant supplementation in type 2 diabetic retinopathy. Eur J Ophthalmol. 2011;21:637-43.
- Tikhonenko M, Lydic TA, Opreanu M, Li Calzi S, Bozack S, McSorley KM, et al. N-3 polyunsaturated Fatty acids prevent diabetic retinopathy by inhibition of retinal vascular damage and enhanced endothelial progenitor cell reparative function. PLoS One. 2013;8(1):e55177.
- Sapieha P, Chen J, Stahl A, Seaward MR, Favazza TL, Juan AM, et al. Omega-3 polyunsaturated fatty acids preserve retinal function in type 2 diabetic mice. Nutr Diabetes. 2012 Jul 23;2:e36
- Pinazo-Duran MD, Boscá-Gomar L. Anti-inflammatory properties of polyunsaturated fatty acid omega 3. Indications in ophthalmology. Arch Soc Esp Oftalmol. 2012;87:203-5.
- Weijun G, Juming L, Guoqing Y, Jingtao D, Qinghua G, Yiming M, et al. Effects of plasma homocysteine levels on serum HTase/PON activity in patients with type 2 diabetes. Adv Ther. 2008;25(9):884-93
- Alegría Ezquerra E, Castellano Vázquez JM, Alegría Barrero A. Obesity, metabolic syndrome and diabetes: cardiovascular implications and therapy. Rev Esp Cardiol. 2008;61:752-64.
- Ridker PM High- Sensitivity C Reactive Protein, potential Adjunct for Global Risk Assessment in the Primary Prevention of Cardiovascular Disease. Circulation. 2001; 103:1813-8.
- Streja D, Cressey P, Rabkin S. Associations between inflammatory markers, traditional risk factors, and complications in patients with type 2 diabetes mellitus. Diab Complic. 2003;17:120-7.
- Edward T Coming of Age of C- Reactive Protein. Circulation. 2003;107:370-2.
- Davies L, Wilmshurst EG, McElduff A, Gunton J, Clifton-Bligh P, Fulcher GR. The relationship among homocysteine, creatinine clearance, and albuminuria in patients with Type 2 diabetes. Diabetes Care. 2001;24:1805-9.
- Hoogeveen EK, Kostense PJ, Beks PJ, Mackaay AJ, Jakobs C, Bouter LM, et al. Hyperhomo-cysteinaemia is associated with an increased risk of cardiovascular disease, especially in non-insulin-dependent diabetes mellitus: a population-based study. Arterioscler Thromb Vasc Biol. 1998;18:133-8.