Volumen 21 - Número 4 - Octubre-Diciembre 2013
Helicobacter pylori: ¿una nueva causa de uveítis?. Casos clínicos
P. Rocha Cabrera, JA. Abreu Reyes, J. RodrĂguez MartĂn, S. GarcĂa Hernández, MJ. Losada, B. RodrĂguez Lozano, MA. Serrano GarcĂa
Hospital Universitario de Canarias. Tenerife
CORRESPONDENCIA
Pedro Rocha Cabrera
Calle Santo Domingo nº26, 2º Derecha.
Santa Cruz de Tenerife
38003 Tenerife, España
E-mail: procha975@yahoo.es
Calle Santo Domingo nº26, 2º Derecha.
Santa Cruz de Tenerife
38003 Tenerife, España
E-mail: procha975@yahoo.es
RESUMEN
Casos clínicos: mujeres de 44 y 72 años, acuden por uveítis anterior aguda no fibrinoide, se realiza: a la primera, por dispepsia, el test del aliento siendo positivo para Helicobacter Pylori (HP). A la segunda ingresa por hemorragia digestiva alta secundaria a ulcus, tras la endoscopia con toma de muestras, es informada de gastritis crónica con bacilos HP. Ambas reciben la triple terapia erradicadora desapareciendo la actividad uveítica.
Discusión: el HP pudiera ser un desencadenante de la actividad inflamatoria ocular. Sintomatología digestiva positiva en el contexto de una uveítis deberá ser estudiada al menos mediante el test del aliento.
Discusión: el HP pudiera ser un desencadenante de la actividad inflamatoria ocular. Sintomatología digestiva positiva en el contexto de una uveítis deberá ser estudiada al menos mediante el test del aliento.
RESUM
Casos clínics: Presentem dues dones de 44 i 72 anys amb el diagnòstic d’uveïtis anterior aguda no fibrinosa. La primera va presentar test de l’alè positiu per a helicobacter pylori (HP), la segona va ingressar per hemorràgia digestiva alta secundària a ulcus i, després de realitzar-se endoscòpia amb extracció de mostres, s’informa com a gastritis crònica amb bacils HP. Ambdues pacients van rebre triple teràpia per a HP, desapareixent l’activitat uveítica.
Discussió: HP és un desencadenant de l’activitat inflamatòria ocular. La simptomatologia digestiva positiva en el context d’una uveïtis hauria d’ésser estudiat com a mínim amb el test de l’alè.
Discussió: HP és un desencadenant de l’activitat inflamatòria ocular. La simptomatologia digestiva positiva en el context d’una uveïtis hauria d’ésser estudiat com a mínim amb el test de l’alè.
ABSTRACT
Clinical cases: 44 year old woman and 72 years who present a non fibrinoid acute anterior uveitis was carried to the first patient breath test for Helicobacter pylori remain positive (HP), the second patient was admitted for upper gastrointestinal bleeding secondary to ulcer, endoscopy after sampling, was informed of chronic gastritis with HP bacilli. The patients received the triple eradication therapy and the uveitic activity was disappeared.
Discussion: HP is a trigger of ocular inflammatory activity. An episode of gastrointestinal symptoms in the context of uveitis should be studied by breath test.
Discussion: HP is a trigger of ocular inflammatory activity. An episode of gastrointestinal symptoms in the context of uveitis should be studied by breath test.
Introducción
El Helicobacter Pylori (HP) es una bacteria gram negativa que coloniza de forma selectiva el epitelio gástrico1 en aproximadamente el 50% de la población mundial, aunque la prevalencia varía según la edad, raza y área geográfica2. Está implicada en la inflamación crónica gástrica e incrementa el riesgo de desarrollo de úlcera duodenal, gástrica y cáncer gástrico3-5. El 90-95% de las úlceras duodenales y el 70% de las úlceras gástricas están asociadas con el HP. Una vez que el HP coloniza el ambiente gástrico, permanece en el huésped, favoreciendo la respuesta inmune que intenta ineficazmente erradicarla. Esta bacteria puede convivir en el ambiente acidófilo del estómago metabolizando la urea a amonio por la vía de la ureasa sin ser destruida6.Las uveítis idiopáticas se calculan entorno al 35% de todas y el HP pudiera ser una de las causas.
El HP convive en la mucosa gástrica provocando una constante liberación de material antigénico vía hematógena desencadenando una reacción inmune e inflamación en tejidos tan distantes como la úvea7.
Exponemos dos casos clínicos que presentan cuadro uveítico coincidiendo con episodio de gastropatía positiva para HP.
Caso clínico
Mujer de 44 años con antecedentes personales de hepatitis C, acude por uveítis anterior aguda bilateral; la agudeza visual bilateral es de 0,5.En la biomicroscopía destaca Tyndall de 5 células por campo, sin sinequias y con depósitos pigmentarios en cristaloides anterior bilateral (Figura 1).

Figura 1. Biomicroscopia: ausencia de sinequias posteriores sin precipitados queráticos tras la desaparición del Tyndall.
En el fondo de ojo se aprecia alteración del EPR bilateral, sin edema macular (Figura 2 y Figura 3).
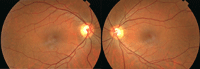
Figura 2. Retinografía derecha e izquierda: alteraciones del epitelio pigmentario retiniano.
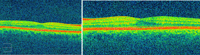
Figura 3. OCT derecho e izquierdo respectivamente, ambos sin alteraciones.
Se diagnostica uveítis anterior aguda bilateral, instaurándose tratamiento tópico y consiguiendo una remisión completa de la inflamación ocular. Se realiza despistaje sistémico habitual siendo todo ello negativo.
La paciente nos comenta dispepsia crónica, por lo que es remitida al Digestivo, que concluye en la existencia de una hernia de hiato y solicita el test del aliento con resultado positivo para HP. Tras la triple terapia con amoxicilina, claritromicina y omeprazol durante una semana éste se negativiza.
Tras el control de su patología digestiva, durante cuatro años de seguimiento, no se ha reactivado el cuadro inflamatorio ocular.
Mujer de 72 años con antecedentes personales de Diabetes Mellitus tipo 2, retinopatía diabética no proliferativa moderada en seguimiento por nuestro servicio e hipertensión arterial. Acude a urgencias por cuadro de dispepsia y melenas. Se practica endoscopia digestiva alta con hemostasia y toma de muestra, apreciándose úlcera gástrica prepilórica que es informada por Anatomía Patológica de “mucosa gástrica con signos inflamatorios crónicos y discreta cantidad de bacilos tipo H. Pylori” tras la realización de técnicas específicas de histoquímica (Figura 4).
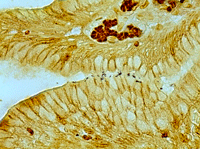
Figura 4. Técnica histoquímica Warthin- Starry para detectar Helicobacter Pylori: se aprecia tinción de microorganismos tipo Helicobacter pylori en las luces glandulares.
Tres semanas más tarde debuta con uveítis anterior aguda unilateral, no fibrinoide, sinequiante en su ojo izquierdo (OI) (Figura 5). Se realiza detección inmunológica e infecciosa, siendo todo ello negativo.

Figura 5. Biomicroscopía ojo izquierdo 1 semana después del debut, se observa que ha existido actividad previa, depósitos pigmentarios sobre la cápsula anterior del cristalino y sinequias que han roto.
La agudeza visual es de 0,15 en ojo derecho (OD) y de 0,2 en OI. En el fondo de ojo derecho se aprecia retinopatía diabética no proliferativa moderada, en OI retinopatía diabética no proliferativa moderada con edema macular, infiltrado vítreo central, la Tomografía de Coherencia Óptica (OCT) es normal en OD y presenta edema macular de 518 micras en OI. En OCT realizada dos meses antes en un control, no existía edema macular en OI.
Tras el control de su patología digestiva y después de un año de seguimiento no se aprecia recidiva uveítica.
Discusión
La uveítis por Helicobacter Pylori es una patología infrecuente. En los casos expuestos, tras la exclusión de todas las enfermedades más frecuentes que causan uveítis, y por la coincidencia del hecho de que las pacientes presentaban un cuadro gástrico en ese mismo momento catalogado por la positividad del HP, se realiza el diagnóstico presuntivo.El HP produce una cascada inmune humoral y celular que puede conducir a una uveítis, caracterizada por la respuesta de Th-1 celular, con producción de IFN-γ y TNF-α8. Las citocinas IL-1, IL-2, IL-6, IL-8, TNF-α son liberadas por los macrófagos activados produciendo mayor inflamación, dichas citocinas están elevadas en los pacientes con uveítis aguda, siendo el TNF-α el que de forma más activa participa en su génesis9. El HP se ha relacionado como factor de riesgo en la patología oclusiva arterial, se sospecha que la coriorretinopatía central serosa es debida a la oclusión vascular de los coriocapilares provocando la enfermedad con la consiguiente ruptura de la capa externa retiniana, la fuga de fluido a través del defecto en el epitelio pigmentario retiniano hacia el espacio subretiniano y dando lugar a un desprendimiento seroso neurosensorial10. El Helicobacter pylori produce una proteína llamada CagA11, algunos estudios señalan que existe una reactividad cruzada de los anticuerpos anticagA con la pared vascular, respondiendo a múltiples patógenos y produciendo una disfunción endotelial, sugiriendo, por consiguiente, que una respuesta inmune frente a CagA puede ser crítica para precipitar una inestabilidad coronaria mediada entre el antígeno CagA y una proteína que está en las placas ateroscleróticas coronarias.
La uveítis por HP no es anecdótica, tras la revisión de estos artículos, ya que puede producir a nivel ocular una disfunción endotelial que provoca alteración de la barrera hematoacuosa.
Dentro del protocolo del diagnóstico de la uveítis anterior aguda idiopática, cuando existan datos sugerentes de sintomatología digestiva, se debería incluir al menos el test del aliento12,13, ya que la triple terapia erradicadora14-16, la cuádruple o la secuencial pueden controlar el brote uveítico evitando así que aparezca recidiva posterior.
Bibliografía
- Falk P, Roth K A, Boren T, et al. An in vitro adherence assay reveals that Helicobacter pylor exhibits cell lineage-specific tropism in the human gastric epithelium. Microbiology. 1993;90:2035-9.
- Brown LM. Helicobacter pylori: Epidemiology and Routes of Transmission. Epidemiologic Reviews. 2000;22(2):283-97.
- McColl KEL. Helicobacter pylori infection. N Engl J Med. 2010;362:1597-604.
- Shiotani A, Nurgalieva ZZ, Yamaoka Y, Graham DY. Helicobacter pylori. Med Clin North Am. 2000;84:1125-36.
- Welin M, Holmgren NM, Nilsson P, Enroth H. Statistical model of the interactions between Helicobacter pylori infection and gastric cancer development. Helicobacter. 2003;8:72-8.
- Weeks DL, Eskandari S, Scott DR, Sachs G. A H+-gated urea channel: the link between Helicobacter pylori urease and gastric colonization. Science. 2000;287:482-5.
- Otasevic L, Walduck A, Meyer TF, Aebischer T, Hartmann C, Orlic N. Helicobacter Pylori infection in anterior uveitis. Infection. 2005;33(2):82-5.
- D’Elios MM, Manghetti M, deCarli M, Costa F, Baldari CT, Burroni D, et al. T helper l effector cells specific for Helicobacter pylori in the gastric antrum of patients with peptic ulcer disease. Journal of Immunology. 1997;158:962-7.
- Perez-Guijo V, Santos-Lacomba M, Sanchez-Hernandez M, Castro-Villegas M del C, Gallardo-Galera JM, Collantes-Estevez E: Tumour necrosis factor-alpha levels in aqueous humour and serum from patients with uveitis: the involvement of HLA-B27. Current Medical Research and Opinion. 2004;20:155-7.
- Giusti C. Association of Helicobacter pylori with central serous chorioretinopathy: hypotheses regarding pathogenesis. Medical Hypotheses. 2004; 63:524-7.
- Censini, S, Lanfge C, Xiang Z, Crabtree J, Ghiara P, Borodovsky R, Rappuolli R, Covacci A. CagA pathogenicity island of Helicobacter pylori, encodes type I-specific and diasease-associated virulence factors. Proc Natl Acad Sci USA. 1996;14648-53.
- Rogge JD, Wagner DR, Carrico RJ, et al. Evaluation of a new urease reagent strip for detection of Helicobacter pylori in gastric biopsy specimens. Am J Gastroenterol. 1995;90:1965-8.
- Malfertheiner P, Megraud F, O’Morain C, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report. Gut. 2007;56:772-81.
- De Francesco V, Zullo A, Margiotta M, et al. Sequential treatment for Helicobacter pylori does not share the risk factors of triple therapy failure. Aliment Pharmacol Ther. 2004;19:407-14.
- Zullo A, Vaira D, Vakil N, et al. High eradication rates of Helicobacter pylori with a new sequential treatment. Aliment Pharmacol Ther. 2003;17:719-26.
- Calvet X, Gene E, Lopez T, et al. What is the optimal length of proton pump inhibitor-based triple therapies for H. pylori? A cost-effectiveness analysis. Aliment Pharmacol Ther. 2001;15:1067-76.